-
铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如下:

(1)“酸溶”时加快反应速率的方法有___________________(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2 +14Fe3+ +8H2O=15Fe2++2SO42-+16H+,则另一个反应的离子方程式为:___________;
②FeS2还原后,检验Fe3+是否反应完全的方法是___________。
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有___杂质;
②写出加入NH4HCO3生成“沉淀”的化学方程式:___________________;
③所得FeCO3需充分洗涤,检验沉淀已洗涤干净的方法是_________________。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为_________(填化学式)。
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧34.8g的FeCO3,得到Fe2O3和FeO的混合物23.76g。则Fe2O3的质量为______ g。
-
铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如下:
(1)“酸溶”时加快反应速率的方法有________________________________(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2 +14Fe3+ +8H2O=15Fe2+ +2SO42-+16H+,则另一个反应的离子方程式为:___________________;②FeS2还原后,检验Fe3+是否反应完全的方法是_______________________。
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有____________杂质;
②写出加入NH4HCO3生成“沉淀”的化学方程式:___________________________;
③所得FeCO3需充分洗涤,检验沉淀已洗涤干净的方法是_______________________。
(4)FeCO3浊液长时间暴露在空气中,会有部 分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为___________________(填化学式)。
分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为___________________(填化学式)。
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO.现煅烧23.2kg的FeCO3,得到Fe2O3和FeO的混合物15.84kg.则Fe2O3的质量为___________kg。
-
铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如下:
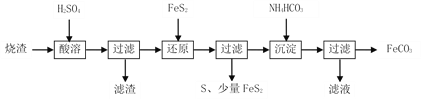
(1)“酸溶”时加快反应速率的方法有___________________(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2 +14Fe3+ +8H2O=15Fe2++2SO42-+16H+,则另一个反应的离子方程式为:___________;
②FeS2还原后,检验Fe3+是否反应完全的方法是___________。
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有___杂质;
②写出加入NH4HCO3生成“沉淀”的化学方程式:___________________;
③所得FeCO3需充分洗涤,检验沉淀已洗涤干净的方法是_________________。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为_________(填化学式)。
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧34.8g的FeCO3,得到Fe2O3和FeO的混合物23.76g。则Fe2O3的质量为______ g。
-
铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备FeCO3的流程如下:
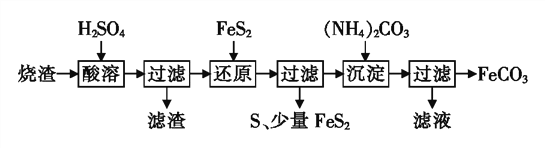
(1)“酸溶”时加快反应速率的方法有______(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:
FeS2+14Fe3++8H2O 15Fe2++2S
15Fe2++2S +16H+,则另一个反应的离子方程式为_________。
+16H+,则另一个反应的离子方程式为_________。
②加入FeS2还原后,检验Fe3+是否反应完全的方法是______________________。
(3)①“沉淀”时,需要控制温度在35 ℃以下,其可能原因是___________________。
②所得FeCO3需充分洗涤,检验沉淀已洗净的方法是______________。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为_______(填化学式)。
(5)写出在空气中煅烧FeCO3制备高纯氧化铁的化学方程式:_________________。FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧23.2 kg的FeCO3,得到Fe2O3和FeO的混合物15.84 kg,则Fe2O3的质量为____kg。
-
工业上用固体硫酸亚铁制取颜料铁红(Fe2O3),反应原理是:2FeSO4
 Fe2O3+SO2↑+SO3↑.
Fe2O3+SO2↑+SO3↑.
某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量.
(SO2沸点为-10.02℃)请回答相关问题:
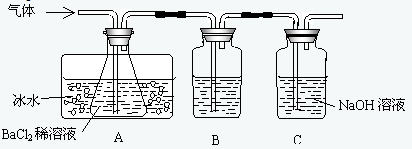
(1)A瓶所盛试剂的作用是______;B瓶所盛的试剂是______;C瓶所盛试剂的作用是______;
(2)A瓶要用冷水冷却的原因是______;
(3)将此反应生成的气体通入A瓶BaCl2溶液中,则______;(填编号)
A.析出BaSO3沉淀 B.析出BaSO4沉淀 C.逸出SO3气体 D.逸出SO2气体
理由是______;
(4)反应后若用A瓶内的混合物来测定已分解的FeSO4的质量,其实验操作的第一步是(简述操作步骤)______.
-
(16分)
某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁。其生产工艺流程如下:
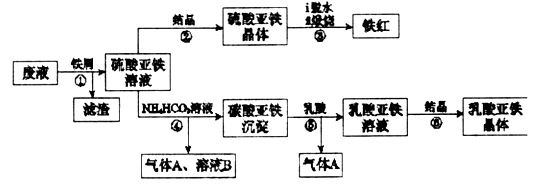
已知:①TiOSO4可溶于水,在水中可以电离为Ti02+和SO4 :
:
②TiOSO4水解的反应为:
请回答:
(1)步骤①所得滤渣的主要成分为______________________________。
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为__________________。
(3)步骤④需控制反应温度低于35℃,其目的是___________________。
(4)步骤④反应的离子方程式是__________________________________。
(5)已知: ,试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_________________________________________________________。
,试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_________________________________________________________。
(6)溶液B常被用于电解生产(NH4)2S208(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_____________________________________。
(7)Fe3+对H2O2的分解具有催化作用。利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是_________________________________。
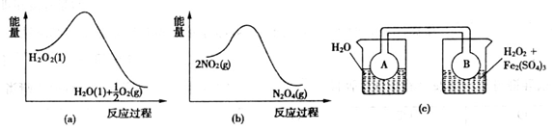
-
(16分)某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁。其生产工艺流程如下:
已知:
①TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-:
②)TiOSO4水解的反应为:TiOSO4+(x+1)H2O=TiO2∙xH2O↓+H2SO4
请回答:
(1)步骤①所得滤渣的主要成分为__________________。
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比_______。
(3)步骤④需控制反应温度低于35℃,其目的是___________________。
(4)步骤④反应的离子方程式是______________________。
(5)已知:FeCO3(s)  Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因__________。
Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因__________。
(6)溶液B常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_____________________________________。
(7)Fe3+对H2O2的分解具有催化作用。利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是______________。
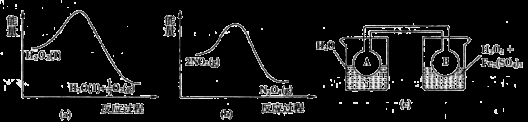
-
某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁.其生产工艺流程如下:
已知:①TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-;
②TiOSO4水解的反应为:TiOSO4+(x+1)H2O→TiO2•xH2O↓+H2SO4.
请回答:
(1)步骤①所得滤渣的主要成分为_____________,
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为_____________,
(3)步骤④需控制反应温度低于35℃,其目的是_____________,
(4)步骤④的离子方程式是_____________,
(5)已知:FeCO3(S) Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_____________,
Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_____________,
(6)溶液B常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_____________,
(7)Fe3+对H2O2的分解具有催化作用.利用图2(a)和(b)中的信息,按图2(c)装置(连通的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的深,其原因是_____________。

-
工业上用固体硫酸亚铁制取颜料铁红,反应原理是:2FeSO4  Fe2O3+SO2↑+SO3↑。某学生欲检验该反应所产生的气态物质,他依次将气体通过盛有(I)BaCl2溶液、( II ) x 溶液、(III)NaOH 溶液的三个装置。则下列对该方案的评价中正确的是 ( )
Fe2O3+SO2↑+SO3↑。某学生欲检验该反应所产生的气态物质,他依次将气体通过盛有(I)BaCl2溶液、( II ) x 溶液、(III)NaOH 溶液的三个装置。则下列对该方案的评价中正确的是 ( )
A.(I)中会生成 BaSO3、BaSO4两种沉淀
B.可将(I)中的 BaCl2溶液改为 Ba ( NO3 )2溶液
C.(II)所盛 x应为品红溶液
D.( III)的作用是检验生成的SO2 气体
-
工业上用固体硫酸亚铁制取颜料铁红,反应原理是:2FeSO4  Fe2O3+SO2↑+SO3↑。某学生欲检验该反应所产生的气态物质,他依次将气体通过盛有(I)BaCl2溶液、( II ) x 溶液、(III)NaOH 溶液的三个装置。则下列对该方案的评价中正确的是 ( )
Fe2O3+SO2↑+SO3↑。某学生欲检验该反应所产生的气态物质,他依次将气体通过盛有(I)BaCl2溶液、( II ) x 溶液、(III)NaOH 溶液的三个装置。则下列对该方案的评价中正确的是 ( )
A.(I)中会生成 BaSO3、BaSO4两种沉淀
B.可将(I)中的 BaCl2溶液改为 Ba(NO3)2溶液
C.(II)所盛 x 应为品红溶液
D.(III)的作用是检验生成的SO2 气体









