-
化学与生活密切相关,下列说法错误的是( )
A. 氯化铵是一种氮肥,其饱和溶液还可以用来清洗铁锈
B. 二氧化硅晶体具有半导体性质,可用于生产计算机芯片
C. 燃煤中加入石灰石可以减少二氧化硫的排放及酸雨的形
D. 食品包装中常放入装有硅胶和铁粉的小袋,可防止食物变质
难度: 中等查看答案及解析
-
我国明代《本草纲目》中收载药物 1892 种,其中“烧酒”条目中写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )
A. 干馏 B. 渗析 C. 萃取 D. 蒸馏
难度: 简单查看答案及解析
-
下列说法错误的是( )
A. 蔗糖和麦芽糖水解的最终产物都是葡萄糖
B. 用灼烧的方法可以区分蚕丝和人造纤维
C. 植物油氢化过程中发生了加成反应
D. 棉、麻、羊毛都属于天然高分子化合物
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 无色溶液中:Na+、NH4+、Cu2+、SO42-
B.
=1×10-12 的溶液中:K+、Na+、CO32-、NO3-
C. 与铝反应产生大量氢气的溶液:Na+、NH4+、HCO3-、Cl-、
D. 酸性溶液中:Na+、ClO-、I-、K+
难度: 中等查看答案及解析
-
下列反应对应的离子方程式书写正确的是( )
A. Cu 溶于稀 HNO3:Cu+4H++2NO3-===Cu2++2NO2↑+2H2O
B. 实验室制 Cl2 的反应: MnO2+4H++2Cl-=====Mn2++Cl2↑+2H2O
C. 醋酸溶液与水垢中的 CaCO3 反应:CaCO3+2H+===Ca2++H2O+CO2↑
D. 向 Al2(SO4)3 溶液中加入过量的氨水:Al3++4NH3·H2O===AlO2-+4NH4++2H2O
难度: 中等查看答案及解析
-
NA 是阿伏加德罗常数的值,下列说法正确的是( )
A. 14g 乙烯和丙烯混合气体中的氢原子数为 2NA
B. 1 mol·L-1 Na2CO3 溶液中,含 CO32-数目小于 NA
C. 标准状况下,2.24LSO3 中含有 SO3 分子数为 0.1NA
D. 1molNa2O2 与足量 CO2 充分反应转移的电子数为 2NA
难度: 中等查看答案及解析
-
25℃时不断将水滴入0.1mol·L-1的氨水中,下列图像变化合理的是( )

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 钢铁表面水膜酸性很弱或呈中性,发生吸氧腐蚀
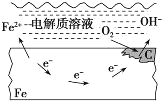
B. 钢铁表面水膜酸性较强,发生析氢腐蚀
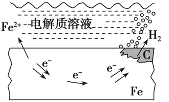
C. 钢闸门作为阴极而受到保护
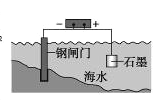
D. 将锌板换成铜板对钢闸门保护效果更好
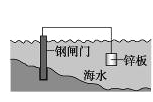
难度: 中等查看答案及解析
-
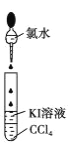
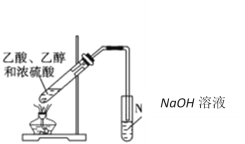
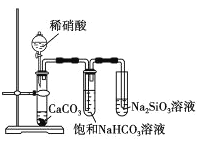
下列实验无法达到实验目的的是( )
A. 检验铵根离子
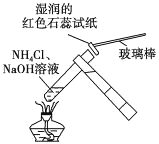
B. 检验碘离子
C. 制取乙酸乙酯
D. 比较氮、碳、硅元素的非金属性
难度: 中等查看答案及解析
-
短周期元素 W、X、Y、Z 的原子序数依次递增,W 的无氧酸溶液能在玻璃容器上刻标记;W 和 X 能形成 XW3 型化合物,X 在化合物中只显一种化合价;W 和 Z 位于同主族,Y 原子最外层电子数等于电子层数的 2 倍。下列有 关推断正确的是( )
A. 原子半径大小为 W<X<Y<Z B. Z 的氢化物水溶液酸性强于 W 的
C. Y 的氧化物对应的水化物均为强酸 D. X 和 Z 形成的化合物的为离子化合物
难度: 中等查看答案及解析
-
海水开发利用的部分过程如图所示。下列说法正确的是( )

A. 过程①中,粗盐的提纯只涉及除杂、结晶等物理过程
B. 过程②中,工业上常用 NaOH 作为沉淀剂得到 Mg(OH)2
C. 过程③中,直接加热蒸干 MgCl2 溶液即可得到无水 MgCl2
D. 过程④中,可以选用 Na2SO3 饱和溶液来代替 SO2 水溶液
难度: 中等查看答案及解析
-
下列实验的实验操作、实验现象和实验结论都正确的是( )
选项
实验操作
实验结论
A
向浓度均为 0.1mol/L 的 MgCl2、CuCl2 混合溶液中逐滴加入氨水,
先出现蓝色沉淀
Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
B
将甲烷与氯气光照下反应后的混合气体通入石蕊试液,试液变红
生成的氯甲烷具有酸性
C
向 NaAlO2 溶液中滴加 NaHCO3 溶液,产生白色沉淀
NaAlO2 和 NaHCO3 发生相互促
进的水解反应
D
向溴水中滴加苯,充分振荡、静置,水层几乎呈无色
苯与溴发生了反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如下图1,电池的工作原理如下图2。下列有关说法正确的是
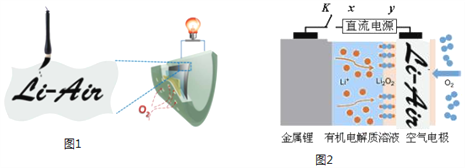
A. 放电时,纸张中的纤维素作锂电池的正极
B. 开关K闭合给锂电池充电,X为直流电源负极
C. 放电时,Li+由正极经过有机电解质溶液移向负极
D. 充电时,阳极的电极反应式为:Li2O2+2e-=O2↑+2Li+
难度: 中等查看答案及解析
-
双键完全共轭(单键与双键相间)的单环多烯烃称为轮烯,[8]轮烯(
)是其中的一种。下列关于该化合物
的说法错误的是( )
A. 与苯乙烯互为同分异构体 B. 能使酸性高锰酸钾溶液褪色
C. 二氯代物有四种 D. 生成 1 mol C8H16 至少需要 4 mol H2
难度: 困难查看答案及解析
-
实验室在 500℃时,隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示 (已知分解的固体产物可能有 FeO、Fe2O3 和 Fe3O4,气体产物可能有 NH3、N2、H2O、SO3 和 SO2)。下列说法正 确的是( )
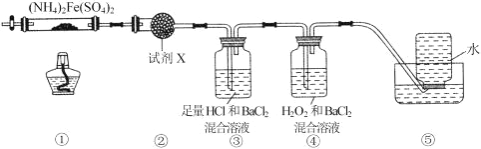
A. 取①中固体残留物与稀硫酸反应并滴加 KSCN,溶液变红,则残留物一定为 Fe2O3
B. 装置②用于检验分解产物中是否有水蒸气生成,试剂 X 最好选用碱石灰
C. 装置③用于检验分解产物中是否有 SO3 气体生成并除去 SO3 和 NH3
D. 装置④用于检验分解产物中是否有 SO2 气体生成,装置⑤用于收集生成的 NH3 和 N2
难度: 中等查看答案及解析
-
已知:pKa=-lgKa,25 ℃时,H2SO3 的 pKa1=1.85,pKa2=7.19。常温下,用 0.1 mol·L-1NaOH 溶液滴定 20 mL0.1 mol·L-1H2SO3 溶液的滴定曲线如右图所示。 下列说法不正确的是( )
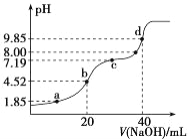
A. a 点所得溶液中:c(HSO3-)=c(H2SO3)
B. b 点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C. c 点所得溶液中:c(Na+)=3c(HSO3-)
D. d 点所得溶液中:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
难度: 困难查看答案及解析

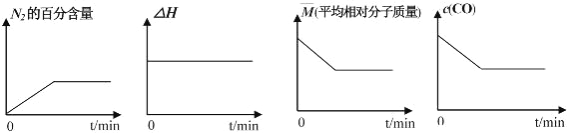
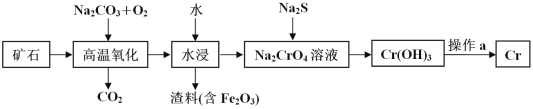
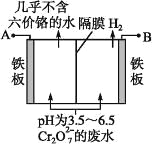
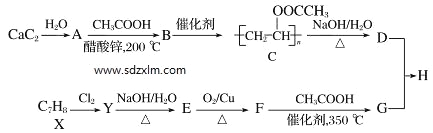
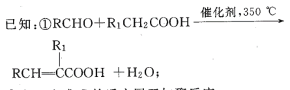
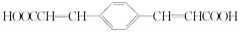 的合成路线(无机 试剂任选) ____。
的合成路线(无机 试剂任选) ____。