-
元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
A. 左下方区域的金属元素
B. 金属元素和非金属元素分界线附近的元素
C. 右上方区域的非金属元素
D. 稀有气体元素
难度: 中等查看答案及解析
-
某元素X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式为
A. H2XO3 B. HXO3 C. H3XO4 D. H2XO4
难度: 简单查看答案及解析
-
煤、石油、天然气是人类使用的主要能源,同时也是重要的化工原料,下列不属于以煤、石油和天然气为主要原料生产的合成材料是( )
A. 塑料 B. 合成橡胶 C. 淀粉 D. 合成纤维
难度: 简单查看答案及解析
-
Se是人体必需微量元素,下列关于
和
的说法正确的是( )
A.
和
互为同位素
B.
和
都含有34个中子
C.
和
分别含有44和46个质子
D.
和
含有不同的电子数
难度: 简单查看答案及解析
-
下列变化不属于化学变化的是( ),
A. 煤的干馏 B. 石油分馏
C. 由乙烯制聚乙烯 D. 重油裂化
难度: 简单查看答案及解析
-
在下列反应中,反应物的总能量低于生成物的总能量的是
A. 2H2+O2
2H2O B. CaCO3
CaO+CO2↑
C. CaO+CO2=CaCO3 D. C2H5OH+3O2
2CO2+3H2O
难度: 中等查看答案及解析
-
下列关于有机化合物的认识中正确的是( )
A. 淀粉、蛋白质、油脂都属于天然高分子化合物
B. C4H10有3种同分异构体
C. 乙烯使溴的四氯化碳溶液褪色是因为发生了取代反应
D. 新制氢氧化铜悬浊液可以鉴别乙酸、葡萄糖和乙醇三种溶液
难度: 简单查看答案及解析
-
已知R2+有b个中子,核外有a个电子,表示R原子符号正确的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
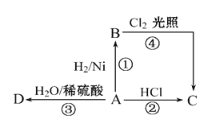
短周期元素X、Y、Z、W在元素周期表中的位置如下图所示,其中W为无机非金属材料的主角,下列说法正确的是
A. W位于第三周期Ⅳ族
B. Y的气态氢化物分子中含极性共价键
C. X的最高价氧化物的电子式是
D. 常温下不能用Z单质制成的容器盛放Y的最高价氧化物对应的水化物的浓溶液
难度: 简单查看答案及解析
-
2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol,这个热化学方程式表示
A. 2g碳燃烧生成一氧化碳时放出221.0kJ的热量
B. 2mol碳燃烧生成一氧化碳时吸收221.0kJ的热量
C. 2mol固体碳在氧气中燃烧生成2mol一氧化碳气体时放出221.0kJ的热量
D. 12g碳和氧气反应生成一氧化碳时放出221.0kJ的热量
难度: 简单查看答案及解析
-
已知H+(aq)+OH-(ag)=H2O(l)△H=-57.3kJ/mol,其中aq代表稀溶液,以下四个反应方程式中,反应热△H=-57.3kJ/mol的是
A. H2SO4(aq)+2NaOH(ag)=Na2SO4(aq)+2H2O(l)
B. 1/2H2SO4(aq)+1/2Ba(OH)2(ag)=1/2BaSO4(aq)+H2O(l)
C. HCl(aq)+NaOH(ag)=NaCl(aq)+H2O(l)
D. HCl(aq)+NH3·H2O(ag)=NH4Cl(aq)+H2O(l)
难度: 简单查看答案及解析
-
在下列结构的有机化合物中:
①CH3CH2CH2CH2CH3 ②CH3CH2CH2CH2CH2CH3 ③
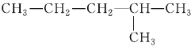
④
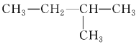 ⑤
⑤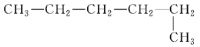
属于同分异构体的正确组合是( )
A. ②和⑤ B. ②和③ C. ①和② D. ④和③
难度: 简单查看答案及解析
-
已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量,②1 mol I2蒸气中化学键断裂时需要吸收151 kJ的能量,③由H原子和I原子形成1 mol HI气态分子时释放299 kJ的能量。下列热化学方程式正确的是
A.2HI(g) =H2(g)+I2(g) ∆H=+11 kJ/mol
B.H2(g)+I2(g) =2HI(g) ∆H=-22 kJ/mol
C.H2(g)+I2(g) =2HI(g) ∆H=+288 kJ/mol
D.H2(g)+ I2(g) =2HI(g) ∆H=-144 kJ/mol
难度: 中等查看答案及解析
-
反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v为
A. v(O2)=0.01mol/(L·s) B. v(NO)=0.08mol/(L·s)
C. v(H2O)=0.003mol/(L·s) D. v(NH3)=0.001mol/(L·s)
难度: 简单查看答案及解析
-
已知在25℃,101kPa下,lgC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是
A. C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(g) ∆H=-48.40kJ/mol
B. C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) ∆H=-5518kJ/mol
C. C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) ∆H=+5518kJ/mol
D. C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) ∆H=-48.40kJ/mol
难度: 简单查看答案及解析
-
某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子,在a g HmX中所含质子的物质的量是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化曲线如图所示。下列因素中,影响该反应速率的主要因素是
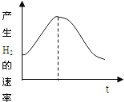
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A. ①④ B. ③④ C. ①③ D. ②③
难度: 简单查看答案及解析
-
(CH3CH2)2CHCH3的正确命名是
A. 3-甲基戊烷 B. 2-甲基戊烷
C. 2-乙基丁烷 D. 3-乙基丁烷
难度: 简单查看答案及解析
-
已知汽车尾气无害化处理反应为
。
下列说法不正确的是 ( )
A. 升高温度可使该反应的逆反应速率降低 B. 使用高效催化剂可有效提高正反应速率 C. 反应达到平衡后,N0的反应速率保持恒定 D. 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
难度: 中等查看答案及解析
-
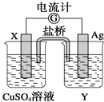
有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置
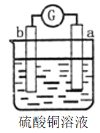
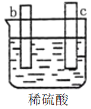
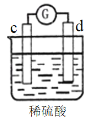
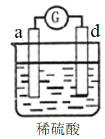
部分实验现象
a极质量减小
b极质量增加
b极有气体产生
c极无变化
d极溶解
c极有气体产生
电流计指示在导线中电流从a极流向d极
由此可判断这四种金属的活动性顺序是
A. a>b>c>d B. d>a>b>c C. b>c>d>a D. a>b>d>c
难度: 简单查看答案及解析
-
镍氢电池的总反应式是H2+2NiO(OH)
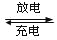 2Ni(OH)2,根据此反应式判断,此电池放电时,负极上发生反应的物质是
2Ni(OH)2,根据此反应式判断,此电池放电时,负极上发生反应的物质是A. NiO(OH) B. Ni(OH)2 C. H2 D. H2和NiO(OH)
难度: 中等查看答案及解析
-
有机物(CH3)3CCH2CH3与氯气发生取代反应,生成的一氯代物有( )
A. 1种 B. 2种 C. 3种 D. 4种
难度: 简单查看答案及解析
-
等物质的量的下列物质,与足量氢气发生加成反应,消耗氢气最多的是
A. CH2===CH—CH===CH2
B.
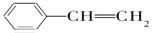
C.
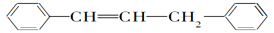
D.
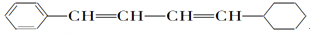
难度: 中等查看答案及解析
-
“绿色化学”是当今社会提出的一个新概念,在“绿色化学工艺”中理想状态是反应物的原子全部转化为目标产物,即原子利用率为100%。下列过程符合“绿色化学”理念的是
A. 实验室制O2:2KClO3
2KCl+3O2↑
B. 2C2H5OH+O2
2CH3CHO+2H2O
C. 2M+N=2P+2Q,2P+M=Q(M、N为原料,Q为期望产品)
D. 用铁屑、CuO、稀硫酸为原料制铜:CuO+H2SO4=CuSO4+H2O、Fe+CuSO4=FeSO4+Cu
难度: 简单查看答案及解析
-
如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是
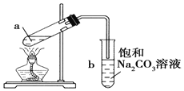
A. 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸
B. 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象
C. 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率
D. 采用长玻璃导管有导气兼冷凝的作用
难度: 简单查看答案及解析
-
催化氧化的产物是
的醇是( )
A.
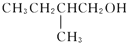 B.
B. 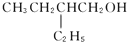
C.
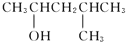 D.
D. 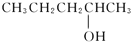
难度: 中等查看答案及解析
-
冶炼金属一般有下列4种方法:①焦炭法;②水煤气法(或氢气、或一氧化碳)法;③活泼金属置换法;④电解法。4种方法在工业上均有应用。古代有(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜。现代有(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁。对它们的冶炼方法的分析不正确的是
A. (Ⅰ)用① B. (Ⅱ)用② C. (Ⅲ)用③ D. (Ⅳ)用④
难度: 简单查看答案及解析
-
将4molA气体和2molB气体在2L的密闭容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)
xC(g),若经2s后测得A的物质的量为2.8mol,C的物质的量浓度为0.6mol/L。以下说法中正确的是
A. 2s内物质A的平均反应速率为0.6mol-1·l-1·s-1 B. 2s时物质B的转化率为70%
C. 2s内物质B的平均反应速率为0.6mol-1·l-1·s-1 D. x=2
难度: 简单查看答案及解析
-
由质量均为100g的铁片、铜片和足量CuSO4溶液组成原电池装置,经过一段时间后,两电极的质量差变为12g,则下列说法正确的是( )
A. 铁片溶解了12g B. 导线中通过了0.2mol电子
C. 铜片上析出了6gCu D. 铜片溶解了6.4g
难度: 简单查看答案及解析