-
溶液X中含有右表离子中的某5种,且其浓度均为0.1 mol·L−1(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是
阳离子
阴离子
Na+、Fe3+、Ca2+、Fe2+、Mg2+、Al3+
OH−、NO3−、HCO3−、CO32−、SO42−、Cl−
A. X溶液中一定含3种阳离子、2种阴离子
B. X溶液中不可能含有HCO3− 或CO32−
C. 生成无色气体的离子方程式为:3Fe2+ +NO3−+4H+===3Fe3++NO ↑ +2H2O
D. 根据电荷守恒,原溶液中一定含Mg2+
难度: 困难查看答案及解析
-
央视栏目《国家宝藏》不仅介绍了历史文化知识,彰显了民族自信、文化自信,历史文物本身也蕴含着许多化学知识。下列说法错误的是
A. 南朝·《竹林七贤与启荣期》砖画的砖块的主要成分是二氧化硅
B. 战国·曾侯乙编钟属于青铜制品,青铜是一种铜锡合金
C. 清·乾隆“瓷母”—各种釉彩大瓶中的红色窑变釉的主要成分可能是氧化亚铜
D. 宋·王希孟《千里江山图》卷中的绿色颜料铜绿的主要成分是碱式碳酸铜
难度: 简单查看答案及解析
-
化学与生产、生活、技术密切相关。下列说法正确的是
A. 纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
B. “水滴石穿”不仅包含着“量变到质变”的哲学思想,同时也包含物理和化学变化
C. 节日燃放的烟花,是碱金属、锶、钡、铂、铁等金属元素焰色反应呈现的
D. 工厂中常用的静电除尘装置是根据胶体带电性的性质而设计的
难度: 简单查看答案及解析
-
下列有关物质的性质与用途均正确且具有对应关系的是
A. 明矾[KAl(SO4)2·12H2O]溶于水会形成胶体,可用于自来水的杀菌消毒
B. 金属钠具有强还原性,可用与TiCl4溶液反应制取金属Ti
C. SiO2熔点高,可以用石英坩埚加热熔融碳酸钾
D. Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
难度: 简单查看答案及解析
-
下列各项叙述正确的是
①水玻璃、碱石灰、漂白粉、福尔马林、淀粉均为混合物
②进行中和热的测定实验时,必须用到两个量筒和两个温度计
③由不同种原子间形成的共价键一定是极性共价键
④有单质参加的反应或有单质产生的反应一定是氧化还原反应
⑤碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
⑥蒸馏在天然香料,药物提取及核燃料处理等技术中得到了广泛的应用
⑦Ca(HCO3)2、Fe(OH)3可由化合反应制得,Fe3O4可以由置换反应制得
A. ①③⑤ B. ①⑤⑦ C. ②③⑤⑦ D. ①②④⑥
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的值,下列说法正确的是
A. 46g有机物C2H6O中含有极性共价键的数目一定为7NA
B. 在K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O中,若生成71gCl2转移的电子数目为5/3NA
C. 1 mol的P4O6中含有6 NA个P-O键
D. 将1molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 澄清透明的中性溶液中:Fe3+、Ba2+、NO3-、Cl-
B. 使甲基橙变黄色的溶液中: Na+、AlO2-、SO42-、Cl-
C. Kw/c(H+)=1×10-13mol/L的溶液中: NH4+、Ca2+、Cl-、NO3-
D. 能使红色石蕊试纸变为蓝色的溶液:Na+、Cl−、S2−、ClO−
难度: 简单查看答案及解析
-
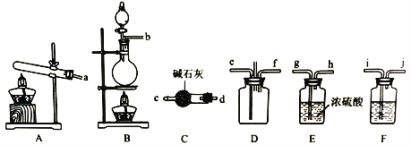
用下列实验装置进行相应实验,设计正确且能达到实验目的的是
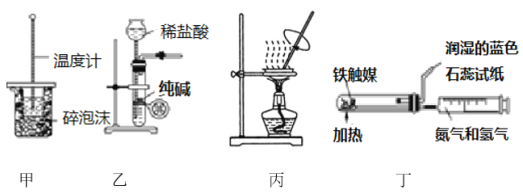
A. 用装置甲进行中和热的测定
B. 用装置乙制取CO2气体
C. 用装置丙蒸发CH3COONa溶液得CH3COONa晶体
D. 用装置丁模拟工业制氨气并检验产物
难度: 中等查看答案及解析
-
厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中正确的是

A. 1mol NH4+ 所含的质子总数为10NA
B. 1mol联氨(N2H4)中含有5mol共价键
C. 1molNH4+经过过程I、II、III,(假设每步转化均完全)得到氮气的体积约为11.2L
D. 该方法每处理1molNH4+,需要的NO2—为0.5mol
难度: 困难查看答案及解析
-
某同学用Na2CO3和NaHCO3溶液进行如图所示实验。下列说法中不正确的是
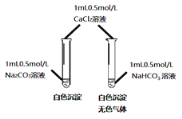
A. 实验前pH(Na2CO3)>pH(NaHCO3)
B. 实验后两溶液中离子种类完全相同
C. Na2CO3溶液中生成的沉淀比NaHCO3溶液中生成的沉淀多
D. 两溶液中反应的基本类型相同
难度: 简单查看答案及解析
-
a、b、c、X是中学化学中常见的四种物质,且a、b、c中含有同一种元素,其转化关系如下图所示。下列说法不正确的是( )
A. 若a、b、c均为厨房中常用的物质,则构成c中的阳离子半径小于其阴离子半径
B. 若a为一种气态氢化物,X为O2,则a分子中可能含有10个或者18个电子
C. 若b为一种两性氢氧化物,则X可能是强酸,也可能是强碱
D. 若a为固态非金属单质,X为O2,则O元素与a元素的原子序数之差可能为8
难度: 困难查看答案及解析
-
碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

下列说法正确的是
A. 分离器中的物质分离操作为过滤
B. 膜反应器中,增大压强有利于提高速率和HI的平衡转化率
C. 该工艺中I2和HI的相互转化体现了“碘循环”
D. 碘循环工艺的总反应为2SO2+4H2O+ I2=H2+2H2SO4+2HI
难度: 中等查看答案及解析
-
下列有关实验操作,现象和解释或结论都正确的是
操作
现象
解释或结论
A
向饱和Na2CO3 溶液中通入足量CO2
溶液变浑浊
析出了NaHCO3晶体
B
向含有酚酞的烧碱溶液中通入SO2
溶液红色退去
二氧化硫有漂白性
C
用洁净铂丝蘸取溶液进行焰色反应
火焰呈黄色
溶液中有Na+、无K+
D
向NaHCO3溶液中滴加NaAlO2溶液
有白色沉淀和气体产生
AlO2-与HCO3-发生了双水解反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 用碳酸氢钠溶液检验水杨酸中的羧基:
+2HCO3-→
+2H2O+2CO2↑
B. 在NaHCO3溶液中加入过量Ba(OH)2溶液:HCO3—+Ba2++OH—= BaCO3↓+H2O
C. 向Mg(HCO3)2溶液中加入过量NaOH溶液,产生白色沉淀:Mg2++2HCO3-+2OH- = MgCO3↓+2H2O
D. 用高锰酸钾溶液滴定草酸:2MnO4-+16H++5C2O42- = 2Mn2++10CO2↑+8H2O
难度: 中等查看答案及解析
-
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+4OH- = Fe3O4↓+S4O62-+2H2O。下列说法不正确的是
A. 参加反应的氧化剂与还原剂的物质的量之比为1∶5
B. 若有2 mol Fe2+被氧化,则被Fe2+还原的O2的物质的量为0.5 mol
C. 每生成1 mol Fe3O4,反应转移的电子为4 mol
D. O2是氧化剂,S2O32-与Fe2+是还原剂
难度: 中等查看答案及解析
-
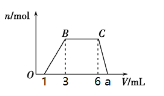
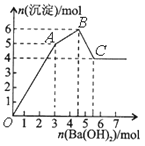
将镁铝合金溶于100mL稀硝酸中,产生1.12LNO气体(标准状况),向反应后的溶液中加入NaOH溶液,产生沉淀情况如图所示。下列说法不正确的是

A. 原溶液中c(HNO3)=2.6mol/L B. 沉淀最大质量为4.08g
C. m(Mg):m(Al)=8:9 D. 氢氧化钠溶液浓度为3mol/L
难度: 困难查看答案及解析
-
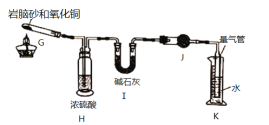
为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是( )

A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
难度: 中等查看答案及解析
-
某氮肥样品可能含有NH4HCO3、NH4C1、NH4NO3中的一种或几种。称取该样品1.000克,溶于水配成100mL溶液。将溶液分成两等份依次完成如下实验:
①向一份溶液中加入10mL 0.2mol•L-1的盐酸与之充分反应,可收集到标准状况下的CO2气体44.8mL(设产生的CO2全部逸出)。
②向另一份溶液中加入足量的6mol•L-1氢氧化钠溶液,加热,产生的气体(设产生的NH3全部逸出)至少需要25mL 0.15mol•L-1的硫酸才能被完全反应。
下列说法正确的是( )
A. 1.000 g样品中一定含有NH4HCO3 0.316克
B. 向①反应所得的溶液中加入硝酸酸化的硝酸银溶液,若有白色沉淀生成,说明原样品中一定含有NH4C1
C. 原样品的含氮量为21%
D. 无需另外再设计实验验证,就能确定原样品中是否含有NH4Cl
难度: 困难查看答案及解析
-
向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成的pH列于下表(已知:偏铝酸钡易溶于水)。以下推断正确的是
氢氧化物
溶液pH
开始沉淀
沉淀完全
Fe(OH)3
2.3
3.4
Al(OH)3
3.3
5.2
A. OA段产生的沉淀为BaSO4和Fe(OH)3
B. 据图计算原溶液中c(Cl-)=c(SO42-)
C. AB段可能发生的反应是:2SO42-+ 2Ba2+ + Al3+ +3OH-=2BaSO4↓+Al(OH)3↓
D. C点溶液呈碱性是因为AlO2-水解,离子方程式为:AlO2-+2H2O=Al(OH)3 +OH-
难度: 困难查看答案及解析