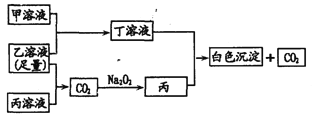
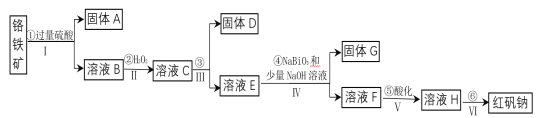
-
下列对于过氧化钙(CaO2)的叙述错误的是
A. CaO2具有氧化性,对面粉可能具有增白作用
B. CaO2中阴阳离子的个数比为1:1
C. CaO2和水反应时,每产生1mol O2转移电子4mol
D. CaO2和CO2反应的化学方程式为:2CaO2+2CO2=2CaCO3+O2
难度: 简单查看答案及解析
-
硫代硫酸钠溶液与氯气能发生反应:Na2S2O3+4Cl2+5H2O=2NaCl+6HCl+2H2SO4,下列说法错误的是
A. 若0.5molNa2S2O3作还原剂,则转移4mol电子
B. 当Na2S2O3过量时,溶液能出现浑浊
C. 氧化产物、还原产物的物质的量之比为1∶1
D. 硫代硫酸钠溶液吸收氯气后,溶液的pH降低
难度: 困难查看答案及解析
-
下列物质分类正确的是
A. SO2、SiO2、NO2均为酸性氧化物
B. CH3COONa、BaCO3、盐酸都是强电解质
C. 淀粉溶液、纳米材料、稀豆浆均为胶体
D. 水煤气、聚乙烯、福尔马林均为混合物
难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是
A. 0. 1 mol·L−1KI 溶液:Na+、K+、ClO− 、OH−
B. 0. 1 mol·L−1Fe2(SO4)3溶液:Mg2+、NH4+、HCO3−、SO42−
C. 0. 1 mol·L−1HCl 溶液:Ba2+、K+、CH3COO−、NO3−
D. 0. 1 mol·L−1NaOH溶液:K+、Na+、SO42−、AlO2-
难度: 简单查看答案及解析
-
2SO2(g)十O2(g) ⇌ 2SO3(g) △H = -198 kJ·mol-1,在V2O5存在时,该反应机理为:Ⅰ:V2O5+ SO2→2VO2 +SO3(快) Ⅱ: 4VO2+O2→2V2O5(慢),下列说法正确的是
A. 反应速率主要取决于Ⅰ步反应
B. 该反应逆反应的活化能大于198kJ/mol
C. 2molSO2和1molO2在一定条件下充分反应能放出198KJ的热量
D. VO2在反应中起催化剂的作用降低了反应活化能加快反应速率
难度: 中等查看答案及解析
-
设NA是阿伏加德罗常数的值,下列说法正确的是
A. 0.1mol FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA
B. 常温下,78 g Na2O2中含有的阴离子数是2NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. pH=1的H2SO4溶液中,含有H+的数目为0.1NA
难度: 简单查看答案及解析
-
把含硫酸铵和硝酸铵的混合液a L分成两等份.一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42﹣完全沉淀,则原溶液中NO3﹣的物质的量浓度为 ( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-===2Mn2++10CO2↑+8H2O
B. Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
C. 惰性电极电解MgCl2溶液:2Cl−+2H2O
Cl2↑+2OH-+ H2↑
D. 向NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH- ===BaSO4↓+H2O
难度: 中等查看答案及解析
-
已知:将Cl2通入适量NaOH溶液中,产物中可能含有NaCl、NaClO、NaClO3,c(Cl-)/c(ClO-)的值与温度高低有关。当n(NaOH)=a mol时,下列说法不正确的是
A. 参加反应的氯气的物质的量等于(1/2)a mol
B. 改变温度,产物中NaC1O3的最大理论产量为(1/7)a mol
C. 改变温度,反应中转移电子的物质的量n(e-)的范围为(1/2)amol ≤ n(e-) ≤ (5/6)amol
D. 若某温度下,反应后c(Cl-)/c(ClO-)= 11,则溶液中c(ClO-)/c(ClO3-)= 1/2
难度: 困难查看答案及解析
-
下列装置的线路接通后,经过一段时间,溶液的pH明显下降的是
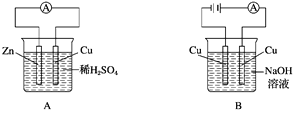

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
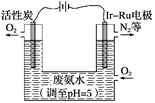
某化学课外活动小组拟用铅蓄电池进行电絮凝净水的实验探究,设计的实验装置如图所示,下列叙述正确的是( )
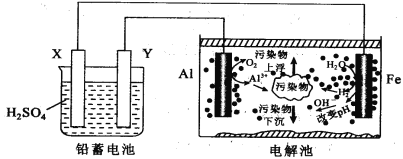
A. Y 的电极反应: Pb-2e- = Pb2+
B. 铅蓄电池工作时SO42-向 Y 极移动
C. 电解池的反应仅有2Al+6H2O
2Al(OH)3+3H2↑
D. 每消耗 103.5 gPb ,理论上电解池阴极上有0.5 molH2生成
难度: 中等查看答案及解析
-
已知:2CH3COCH3(1)
CH3COCH2COH(CH3)2(1)。取等量CH3COCH3分别在0℃和20℃下反应,测得其转化率(α)随时间(t)变化的关系曲线如图所示。下列说法正确的是
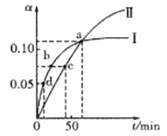
A. 曲线Ⅱ表示20℃时的转化反应
B. 升高温度能提高反应物的平衡转化率
C. 在a点时,曲线Ⅰ和Ⅱ表示反应的化学平衡常数相等
D. 化学反应速率的大小顺序为:d>b>c
难度: 中等查看答案及解析
-
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g) ⇌ 2Z(g),ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
下列说法正确的是。
A. 反应前2 min的平均速率v(Z)=2.0×10-3mol·L-1·min-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.3 mol Z,平衡时X的体积分数增大
难度: 中等查看答案及解析
-
常温下,下列有关溶液的说法正确的是
A. NH4HCO3溶液中存在:c(NH4+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B. pH相等的①NH4Cl、②NH4Al(SO4)2、③NH4HSO4溶液:浓度的大小顺序为①>②>③
C. HA的电离常数Ka =4.93×10−10,则等浓度的NaA、HA混合溶液中:c(Na+) >c(HA) >c(A−)
D. NaHCO3溶液加水稀释,c(Na+)与c(HCO3−)的比值将减小
难度: 中等查看答案及解析
-
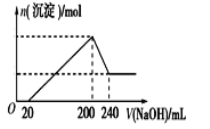
向10mL 1 mol·L-1的HCOOH溶液中不断滴加1 mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lg c水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是
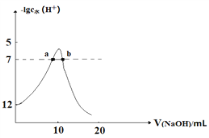
A. 常温下,Ka(HCOOH)的数量级为10-4
B. a、b两点pH均为7
C. 从a点到b点,水的电离程度先增大后减小
D. 混合溶液的导电性逐渐增强
难度: 中等查看答案及解析
-
硫酸锶(SrSO4)常用于烟火和陶瓷工业,可在Na2SO4溶液中加入锶盐溶液沉淀而得。下图表示不同温度下,SrSO4溶液中lg[c( Sr2+)]与lg[c( SO42-)]之间的关系。下列有关说法正确的是 ( )
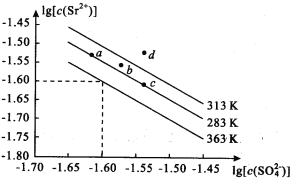
A. 图像中a 、c两点的溶度积Ksp ( a ) < Ksp ( c )
B. 363K时Ksp (SrSO4) = 1.0×10ˉ3.2
C. SrSO4的溶解度随温度升高而增大
D. 313K时,b点对应的溶液为饱和溶液,d点对应的溶液为不饱和溶液
难度: 中等查看答案及解析