-
“废气”的综合处理与应用技术是科研人员的重要研究课题,CO、SO2、NO2是重要的大气污染气体。
(1)处理后的CO是制取新型能源二甲醚(CH3OCH3)的原料。
已知①CO(g)+H2O(g) ⇌ CO2(g)+H2(g) ΔH1= -41.0 kJ/mol
②CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g) ΔH2= -49.0 kJ/mol
③CH3OCH3(g)+H2O(g) ⇌ 2CH3OH(g) ΔH3= +23.5 kJ/mol
则反应2CO(g)+4H2(g) ⇌ CH3OCH3(g)+H2O(g)的△H=________.
(2)已知973 K时,SO2与NO2反应生成SO3和NO,将混合气体经冷凝分离出的SO3可用于制备硫酸。
①973 K时,测得:NO2(g) ⇌ NO(g)+  O2(g) K1=0.018;SO2(g) +
O2(g) K1=0.018;SO2(g) +  O2(g) ⇌SO3(g) K2=20;则反应SO2(g)+NO2(g) ⇌SO3(g)+NO(g)的K3=________
O2(g) ⇌SO3(g) K2=20;则反应SO2(g)+NO2(g) ⇌SO3(g)+NO(g)的K3=________
②973K时,向容积为2 L的密闭容器中充入SO2、NO2 各0.2mol。平衡时SO2的转化率为______。
③恒压下,SO2的分压PSO2随温度的变化如图所示:
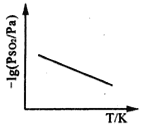
当温度升高时,SO2(g)+NO2(g) ⇌SO3(g)+NO(g)的化学平衡常数______(填“增大”或“减小”), 判断理由是______________________。
(3)用纳米铁可去除污水中的NO3-。
①纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O。研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是______________________。
②相同条件下,纳米铁粉去除不同水样中的NO3-的速率有较大差异。下表中Ⅰ和Ⅱ产生差异的原因可能是________________________________________;Ⅱ中0~20min,用NO3-表示的平均反应速率为______________mol·L-l·min-1。
| 反应时间/min | 0 | 10 | 20 | 30 | 40 |
| Ⅰ | c(NO3-)/10-4 mol·L-1 | 8 | 3.2 | 1.6 | 0.8 | 0.64 |
| Ⅱ | c(NO3-)/10-4 mol·L-1 (含少量Cu2+) | 8 | 0.48 | 0.32 | 0.32 | 0.32 |
(4)用NaOH溶液吸收SO2可得NaHSO3溶液,对NaHSO3溶液中各离子浓度的关系,下列分析不合理的是___。(已知常温下K1(H2SO3)=1.5×10-2,,K2(H2SO3)=1.02×10-7)
A.c(Na+)+c(H+)=c(HSO3-) +2c(SO32-) +c(OH-)
B.c(Na+) =c(HSO3-) +c(SO32-) +c(H2SO3)
C.c(Na+) >c(SO32-) >c(HSO3-) > (OH-)c>c(H+)
D.c(H+) +c(SO32-) =c(OH-) +c(H2SO3)
-
“废气”的综合处理与应用技术是科研人员的重要研究课题,CO、SO2、NO2是重要的大气污染气体。
(1)处理后的CO是制取新型能源二甲醚(CH3OCH3)的原料。
已知①CO(g)+H2O(g) ⇌ CO2(g)+H2(g) ΔH1= -41.0 kJ/mol
②CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g) ΔH2= -49.0 kJ/mol
③CH3OCH3(g)+H2O(g) ⇌ 2CH3OH(g) ΔH3= +23.5 kJ/mol
则反应2CO(g)+4H2(g) ⇌ CH3OCH3(g)+H2O(g)的△H=________.
(2)已知973 K时,SO2与NO2反应生成SO3和NO,将混合气体经冷凝分离出的SO3可用于制备硫酸。
①973 K时,测得:NO2(g) ⇌ NO(g)+  O2(g) K1=0.018;SO2(g) +
O2(g) K1=0.018;SO2(g) +  O2(g) ⇌SO3(g) K2=20;则反应SO2(g)+NO2(g) ⇌SO3(g)+NO(g)的K3=________
O2(g) ⇌SO3(g) K2=20;则反应SO2(g)+NO2(g) ⇌SO3(g)+NO(g)的K3=________
②973K时,向容积为2 L的密闭容器中充入SO2、NO2 各0.2mol。平衡时SO2的转化率为______。
③恒压下,SO2的分压PSO2随温度的变化如图所示:
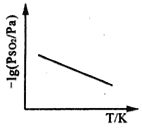
当温度升高时,SO2(g)+NO2(g) ⇌SO3(g)+NO(g)的化学平衡常数______(填“增大”或“减小”), 判断理由是______________________。
(3)用纳米铁可去除污水中的NO3-。
①纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O。研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是______________________。
②相同条件下,纳米铁粉去除不同水样中的NO3-的速率有较大差异。下表中Ⅰ和Ⅱ产生差异的原因可能是________________________________________;Ⅱ中0~20min,用NO3-表示的平均反应速率为______________mol·L-l·min-1。
| 反应时间/min | 0 | 10 | 20 | 30 | 40 |
| Ⅰ | c(NO3-)/10-4 mol·L-1 | 8 | 3.2 | 1.6 | 0.8 | 0.64 |
| Ⅱ | c(NO3-)/10-4 mol·L-1 (含少量Cu2+) | 8 | 0.48 | 0.32 | 0.32 | 0.32 |
(4)用NaOH溶液吸收SO2可得NaHSO3溶液,对NaHSO3溶液中各离子浓度的关系,下列分析不合理的是___。(已知常温下K1(H2SO3)=1.5×10-2,,K2(H2SO3)=1.02×10-7)
A.c(Na+)+c(H+)=c(HSO3-) +2c(SO32-) +c(OH-)
B.c(Na+) =c(HSO3-) +c(SO32-) +c(H2SO3)
C.c(Na+) >c(SO32-) >c(HSO3-) > (OH-)c>c(H+)
D.c(H+) +c(SO32-) =c(OH-) +c(H2SO3)
-
“废气”的综合处理与应用技术是科研人员的重要研究课题,CO、SO2、NO2是重要的大气污染气体。
(1)捕集处理后的CO是制取新型能源二甲醚(CH3OCH3)的原料,已知:①CO(g)+H2O(g) CO2(g)+H2(g),△H1=-41.0kJ•mol-1,②CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2=-49.0kJ•mol-1,③CH3OCH2(g)+H2O(g)
CO2(g)+H2(g),△H1=-41.0kJ•mol-1,②CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2=-49.0kJ•mol-1,③CH3OCH2(g)+H2O(g) 2CH3OH(g)△H3=+23.5kJ•mol-1,则反应2CO(g)+4H2(g)
2CH3OH(g)△H3=+23.5kJ•mol-1,则反应2CO(g)+4H2(g) CH3OCH2(g)+H2O(g)的△H=______。
CH3OCH2(g)+H2O(g)的△H=______。
(2)采用NaClO2溶液作为吸收剂可对烟气进行脱硝。323K下,向足量碱性NaClO2溶液中通入含NO的烟气,充分反应后,溶液中离子浓度的分析结果如下表,依据表中数据,写出NaClO2溶液脱硝过程中发生的总反应的离子方程式:______。
| 离子 | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 2.0×10-4 | 1.0×10-4 | 1.75×10-4 |
(3)已知973K时,SO2与NO2反应生成SO3和NO,混合气体经冷凝分离出的SO3可用于制备硫酸。
①973K时测得:NO2(g) NO(g)+1/2O2(g)K1=0.018;SO2(g)1/2+O2(g)⇌SO3(g)K3=20.则反应SO2(g)+NO2(g)
NO(g)+1/2O2(g)K1=0.018;SO2(g)1/2+O2(g)⇌SO3(g)K3=20.则反应SO2(g)+NO2(g) O3(g)+NO(g)的K3=______。
O3(g)+NO(g)的K3=______。
②973K时,向体积为1L的恒容密闭容器中充入SO2、NO2各aml,平衡时SO2的转化率为______。
③恒压下SO2的分压p(SO2)随温度的变化如图所示。当温度升高时,SO2(g)+NO2(g) SO2(g)+NO(g)的化学平衡常数______(填“增大”或”减小”),判断理由是______。
SO2(g)+NO(g)的化学平衡常数______(填“增大”或”减小”),判断理由是______。
(4)用纳米铁可去除污水中的NO3-,反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O;相同温度下,纳米铁粉去除不同水样中的NO3-的速率有较大差异,下表中Ⅰ和Ⅱ产生差异的原因可能是______;Ⅱ中0~20mim内用NO3-表示的平均反应速率为______mol•L-1•min-1。
| 反应时间/min | 0 | 10 | 20 | 30 | 40 |
| Ⅰ | c(NO3-)/10-4mol•L-1 | 8 | 3.2 | 1.6 | 0.8 | 0.64 |
| Ⅱ | c(NO3-)/10-4mol•L-1(含少量Cu2+) | 8 | 0.48 | 0.32 | 0.32 | 0.32 |
-
“废气”的综合处理与应用技术是科研人员的重要研究课题,CO、SO2、NO2是重要的大气污染气体。
(1)处理后的CO是制取新型能源二甲醚(CH3OCH3)的原料。
已知①CO(g)+H2O(g) CO2(g)+H2(g) ΔH1=-41.0 kJ/mol
CO2(g)+H2(g) ΔH1=-41.0 kJ/mol
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-49.0 kJ/mol
CH3OH(g)+H2O(g) ΔH2=-49.0 kJ/mol
③CH3OCH3(g)+H2O(g) 2CH3OH(g) ΔH3=+23.5 kJ/mol
2CH3OH(g) ΔH3=+23.5 kJ/mol
则反应2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的△H=________.
CH3OCH3(g)+H2O(g)的△H=________.
(2)已知973 K时,SO: 与NO2 反应生成SO,和NO,将混合气体经冷凝分离出的SO,可用于制备硫酸。
①973 K时,测得:
NO2(g) NO(g)+ 1/2O2(g) K1=0.018;
NO(g)+ 1/2O2(g) K1=0.018;
SO2(g)+1/2O2(g) SO3(g) K2=20;
SO3(g) K2=20;
则反应SO2(g)+NO2(g) SO3(g)+NO(g)的K3=________
SO3(g)+NO(g)的K3=________
②973K时,向容积为2 L的密闭容器中充人SO2、NO2 各0.2mol。平衡时SO2的转化率为________。
③恒压下,SO2的分压PSO2随温度的变化如图所示:
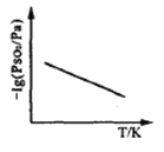
当温度升高时,SO2(g)+NO2(g) SO3(g)+NO(g)的化学平衡常数_____(填“增大”或“减小”), 判断理由 是_________.
SO3(g)+NO(g)的化学平衡常数_____(填“增大”或“减小”), 判断理由 是_________.
(3)用纳米铁可去除污水中的NO3-。
①纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O。研究发现,若PH偏低将会导致NO3-的去除率下降,其原因是___________.
②相同条件下,纳米铁粉去除不同水样中的NO3-的速率有较大差异。
下表中Ⅰ和Ⅱ产生差异的原因可能是____;Ⅱ中0~20min,用NO3-表示的平均反应速率为____mol·L-l·min-1。
| 反应时间/min | 0 | 10 | 20 | 30 | 40 |
| Ⅰ | c(NO3-)/10-4 mol/L | 8 | 3.2 | 1.6 | 0.8 | 0.64 |
| Ⅱ | c(NO3-)/10-4 mol/L (含少量Cu2+) | 8 | 0.48 | 0.32 | 0.32 | 0.32 |
(4)用NaOH溶液吸收SO2可得NaHSO3溶液,对NaHSO3溶液中各离子浓度的关系,下列分析不合理的是___。(已知常温下K1(H2SO3)=1.5×10-2,,K2(H2SO3)=1.02×10-7)
A.[Na+]+[H+]=[HSO3-]+2[SO32-]+[OH-]
B.[Na+]=[HSO3-]+[SO32-]+[H2SO3]
C.[Na+]>[SO32-]>[HSO3-]>[OH-]>[H+]
D.[H+]+[SO32-]=[OH-]+[H2SO3]
-
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
(1)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为______________________(写出一种即可)。
(2)25℃ 101KPa,将1molCH4与一定量的O2混合后,充入一密闭绝热容器内,在连续电火花的作用下反应,恢复至原状况放出QkJ热量,容器内无无CH4和O2剩余且无固体物质生成,装置内气体全部通入足量的碱石灰后,剩余bmol气体。则:
①反应开始时CH4与O2的物质的量之比为___________________________。
②若已知 C(s) + O2(g) = CO2(g) △H1= -m kJ/mol
CO2(g) + C(s) = 2CO(g) △H2= +n kJ/mol
则表示CH4燃烧热的热化学方程式为_____________________________________________。
(3)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应,
NO+NO2+Na2CO3===2NaNO2+CO2,2NO2+Na2CO3===NaNO2+NaNO3+CO2
① 用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则混合气体中NO和NO2的体积比为____________。
② 用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是___________________。
(4)氮的固定是几百年来科学家一直研究的课题
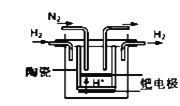
①20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如图所示,正极的电极反应式是___________________________________。
②近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)≒4NH3(g)+3O2(g),则其反应热△H=________________。
(已知:N2(g)+3H2(g)≒2NH3(g)△H=﹣92.4kJ.mol﹣1,2H2(g)+O2(g)≒2H2O(l) △H=﹣571.6kJ.mol﹣1 )
-
)2013年全国各地连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害,因此研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
I.脱硫技术能有效控制SO2对空气的污染。
(1)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、CI-、SO42-、Br-、HCO3-等离子。含SO2的烟气可利用海水脱硫,其工艺流程如下图所示:
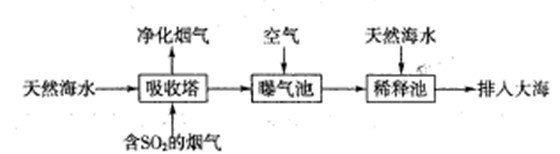
①向曝气池中通入空气的目的是
②通入空气后曝气池中海水与天然海水相比,浓度没有明显变化的离子是 。
a.Cl- B.SO42- C.HCO3-
(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
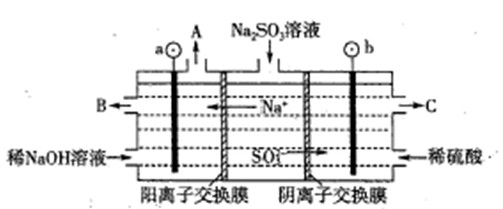
①图中b极要连接电的(填“正”或“负”) 极,C口流出的物质是 。
②SO32-放电的电极反应式为
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因 。
II.我国的能消费结构以燃煤为主,将煤气化可减少环境污染,但煤气化过程中能产生有害气体H2S,用足量的Na2CO3溶液可吸收,该反应的离子方程式为 。
(已知:H2S Kal=9.1×10-8;Ka2=1.1 ×10-12;H2CO3 Kal=4.30×10-7;Ka2=5.61 ×10-11)
-
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
I. 利用反应:6NO2 + 8NH3 7N2 + 12 H2O处理NO2。
7N2 + 12 H2O处理NO2。
II. 一定条件下NO2与SO2可发生反应:NO2(g)+SO2(g) SO3(g)+NO(g) −Q (Q>0) 。
SO3(g)+NO(g) −Q (Q>0) 。
III. CO可用于合成甲醇,反应方程式为:CO(g) + 2H2(g) CH3OH(g) 。
CH3OH(g) 。
(1)硫离子最外层电子的电子排布式为__________________,氨气分子的电子式为___________,氨气分子属于___________分子(填“极性”或者“非极性”)。
(2)C、O、S、N这四种元素中属于同周期元素的非金属性由强到弱的顺序为_______________,能证明其递变规律的事实是(________)
a、最高价氧化物对应水化物的酸性 b、气态氢化物的沸点
c、单质与氢气反应的难易程度 d、其两两组合形成的化合物中元素的化合价
(3)对于I中的反应,120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均反应速率υ(NO2) =_______________。
(4)对于II中的反应,将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是_____________
a. 体系压强保持不变 b. NO2浓度保持不变
c. NO2和SO3的体积比保持不变 d. 混合气体的平均相对分子质量保持不变
(5)请写出II中反应的平衡常数表达式K=_____________________________________。如果II中反应的平衡常数K值变大,该反应___________
a.一定向正反应方向移动 b. 平衡移动时,正反应速率先减小后增大
c.一定向逆反应方向移动 d. 平衡移动时,逆反应速率先增大后减小
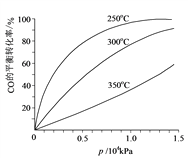
(6)对于III中的反应,CO在不同温度下的平衡转化率与压强的关系如图示。实际生产条件控制在250℃、1.3×104 kPa左右,简述选择此压强的理由:____________________________。
-
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
(1)一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____________(填字母)。
a. 体系压强保持不变
b. 混合气体颜色保持不变
c. 体系中SO3的体积分数保持不变
d. 每消耗1 mol SO2的同时生成1 mol NO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____________。
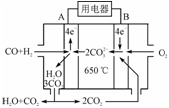
(2)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为________(写出一种即可)。
(3)右图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。A为电池的________(填“正”或“负”)极,写出B极电极反应式:________________________。
(4)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3===2NaNO2+CO2
2NO2+Na2CO3===NaNO2+NaNO3+CO2
① 用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则混合气体中NO和NO2的体积比为__________。
② 用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是____________。
-
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
⑴一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________(填字母)。
a.体系压强保持不变 b.混合气体颜色保持不变
c.体系中SO3的体积分数保持不变 d.每消耗1 mol SO2的同时生成1 mol NO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________。
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为________(写出一种即可)。
⑶右图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。A为电池的________(填“正”或“负”)极,写出B极电极反应式:________________________。
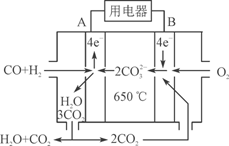
⑷工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3=2NaNO2+CO2
2NO2+Na2CO3=NaNO2+NaNO3+CO2
①用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则混合气体中NO和NO2的体积比为
____________。
②用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是____________。
-
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)如图是在101 kPa、298 K条件下1 mol NO2和1 mol CO反应生成1 mol CO2和1 mol NO过程中能量变化示意图。
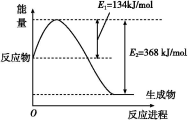
已知:N2(g)+O2(g) 2NO(g) ΔH=+179.5 kJ/mol
2NO(g) ΔH=+179.5 kJ/mol
2NO(g)+O2(g) 2NO2(g) ΔH=-112.3 kJ/mol
2NO2(g) ΔH=-112.3 kJ/mol
则在298 K时,反应:2NO(g)+2CO(g) N2(g)+2CO2(g)的ΔH= 。
N2(g)+2CO2(g)的ΔH= 。
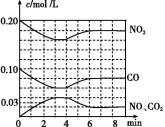
(2)将0.20 mol NO2和0.10 mol CO 充入一个容积恒定为1 L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如图所示。
①下列说法正确的是 (填序号)。
a.容器内的压强不发生变化说明该反应达到平衡
b.当向容器中再充入0.20 mol NO时,平衡向正反应方向移动,K值增大
c.升高温度后,K值减小,NO2的转化率减小
d.向该容器内充入He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO2在0~2 min时平均反应速率v(NO2)= mol/(L·min)。
③第4 min时改变的反应条件为 (填“升温”或“降温”)。
④计算反应在第6 min时的平衡常数K= 。若保持温度不变,此时再向容器中充入CO、NO各0.060 mol,平衡将 移动(填“正向”、“逆向”或“不”)。
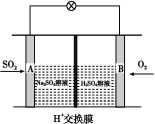
(3)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。其负极的反应式为 ,当有0.25 mol SO2被吸收,则通过质子(H+)交换膜的H+的物质的量为 。
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。现将2×10-4 mol/L的Na2CO3溶液与一定浓度的CaCl2溶液等体积混合生成沉淀,计算应加入CaCl2溶液的最小浓度为 。
O2(g) K1=0.018;SO2(g) +
O2(g) ⇌SO3(g) K2=20;则反应SO2(g)+NO2(g) ⇌SO3(g)+NO(g)的K3=________











