-
)2013年全国各地连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害,因此研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
I.脱硫技术能有效控制SO2对空气的污染。
(1)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、CI-、SO42-、Br-、HCO3-等离子。含SO2的烟气可利用海水脱硫,其工艺流程如下图所示:
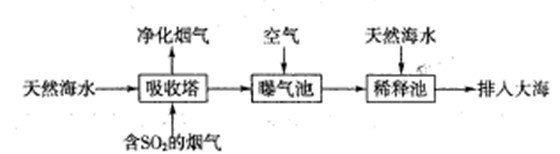
①向曝气池中通入空气的目的是
②通入空气后曝气池中海水与天然海水相比,浓度没有明显变化的离子是 。
a.Cl- B.SO42- C.HCO3-
(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
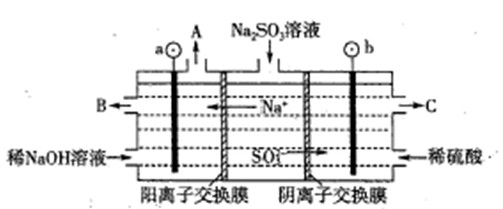
①图中b极要连接电的(填“正”或“负”) 极,C口流出的物质是 。
②SO32-放电的电极反应式为
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因 。
II.我国的能消费结构以燃煤为主,将煤气化可减少环境污染,但煤气化过程中能产生有害气体H2S,用足量的Na2CO3溶液可吸收,该反应的离子方程式为 。
(已知:H2S Kal=9.1×10-8;Ka2=1.1 ×10-12;H2CO3 Kal=4.30×10-7;Ka2=5.61 ×10-11)
-
近年来,天津连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害。研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用钠碱循环法可脱除烟气中的SO2。
①在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是___。
②吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显______性(填“酸”、“碱”或“中”),用化学平衡原理解释:__________。
③当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
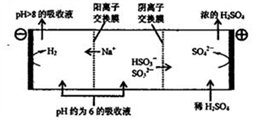
写出HSO3-在阳极放电的电极反应式:____________,当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。
(2)用CH4催化还原NO2可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) =4NO(g) + CO2(g) + 2H2O(g); ΔH=-574 kJ • mol-1
CH4(g) + 4NO(g) =2N2(g) + CO2(g) + 2H2O(g):ΔH=-1160 kJ • mol-1
若用标准状况下4.48 L CH4还原 NO2至N2,整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为_________kJ。
(3)工业上合成氨所需氢气的制备过程中,其中的一步反应为:
CO(g) + H2O(g)  CO2(g) + H2(g): ΔH<0
CO2(g) + H2(g): ΔH<0
—定条件下,将CO(g)与H2O(g)以体枳比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为丨:6,则平衡常数K=__________(计算结果保留两位小数)。
-
严重的雾霾天气,给人们的出行及身体造成了极大的危害,研究NO2、SO2、CO等大气污染气体的形成及处理具有重要意义。
(1)500℃时,在催化剂存在条件下,分别将2molSO2和1molO2置于恒压容器甲和恒容容器乙中(两容器起始容积相同),充分反应,二者均达到平衡后:
①两容器中SO2的转化率关系是甲_____乙(填“>”、“<”或“=”)。
②在容器乙中,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是____(填字母)。
a.温度和容器体积不变,充入1.0molHe b.温度和容器体积不变,充入1.0molO2
c.在其他条件不变时,充入1molSO3 d.在其他条件不变时,改用高效催化剂
(2)利用钠碱循环法可脱除烟气中的SO2。
①在钠碱循环法中,Na2SO3溶液可作为吸收液,可由NaOH 溶液吸收SO2制得,该反应的离子方程式是_______________。
②吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91: 9 | 1:1 | 9: 91 |
| pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显_____性(填“酸”、“碱”或“中”),用化学平衡原理解释:________。
(3)用CH4催化剂还原NO2可以消除氮氧化的污染,例如:
CH4(g)+4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) △H=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+ 2H2O(g) △H=-1160kJ/mol
若用标准状况下4.48CH4还原NO2至N2,整个过程中转移的电子总数为_____(阿伏加德罗常数的值用NA表示),放出的热量为_______kJ。
(4)工业上合成氨所需氢气的制备过程中,其中的一步反应为:CO(g)+H2O(g)====CO2(g)+ H2(g) △H<0。一定条件下,将CO(g)与H2O(g)以体积比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为1:6.则平衡常数K=______(计算结果保留两位小数)。
-
严重的雾霾天气,给人们的出行及身体造成了极大的危害,研究NO2、SO2、CO等大气污染气体的形成及处理具有重要意义。
(1)500℃时,在催化剂存在条件下,分别将2molSO2和1molO2置于恒压容器甲和恒容容器乙中(两容器起始容积相同),充分反应,二者均达到平衡后:
①两容器中SO2的转化率关系是甲_____乙(填“>”、“<”或“=”)。
②在容器乙中,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是____(填字母)。
a.温度和容器体积不变,充入1.0molHe b.温度和容器体积不变,充入1.0molO2
c.在其他条件不变时,充入1molSO3 d.在其他条件不变时,改用高效催化剂
(2)利用钠碱循环法可脱除烟气中的SO2。
①在钠碱循环法中,Na2SO3溶液可作为吸收液,可由NaOH 溶液吸收SO2制得,该反应的离子方程式是_______________。
②吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91: 9 | 1:1 | 9: 91 |
| pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显_____性(填“酸”、“碱”或“中”),用化学平衡原理解释:________。
(3)用CH4催化剂还原NO2可以消除氮氧化的污染,例如:
CH4(g)+4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) △H=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+ 2H2O(g) △H=-1160kJ/mol
若用标准状况下4.48CH4还原NO2至N2,整个过程中转移的电子总数为_____(阿伏加德罗常数的值用NA表示),放出的热量为_______kJ。
(4)工业上合成氨所需氢气的制备过程中,其中的一步反应为:CO(g)+H2O(g)====CO2(g)+ H2(g) △H<0。一定条件下,将CO(g)与H2O(g)以体积比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为1:6.则平衡常数K=______(计算结果保留两位小数)。
-
雾霾天气给人们的出行带来了极大的不便,因此研究NO2、SO2等大气污染物的处理具有重要意义。
(1)某温度下,已知:
①2SO2(g)+O2(g) 2SO3(g) △H1=-196.6kJ/mol
2SO3(g) △H1=-196.6kJ/mol
②2NO(g)+O2(g) 2NO2(g)△H2
2NO2(g)△H2
③NO2(g)+SO2(g) SO3(g)+NO(g) △H3=-41.8kJ/mol
SO3(g)+NO(g) △H3=-41.8kJ/mol
则△H2= _____________。
(2)按投料比2:1把SO2和O2加入到一密闭容器中发生反应2SO2(g)+O2(g) 2SO3(g) ,测得平衡时SO2的转化率与温度T、压强p的关系如图甲所示:
2SO3(g) ,测得平衡时SO2的转化率与温度T、压强p的关系如图甲所示:
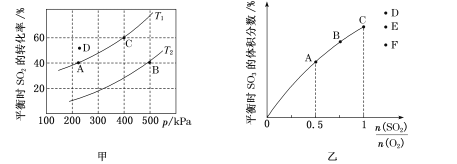
①A、B两点对应的平衡常数大小关系为KA __________(填“>”“<”或“=”,下同)KB;温度为T,时D点vD正与vD逆的大小关系为vD正 _____________vD逆;
②T1温度下平衡常数Kp=______________ kPa-1(Kp为以分压表示的平衡常数,结果保留分数形式)。
(3)恒温恒容下,对于反应2SO2(g)+O2(g) 2SO3(g),测得平衡时SO3的体积分数与起始
2SO3(g),测得平衡时SO3的体积分数与起始 的关系如图乙所示,则当
的关系如图乙所示,则当 =1.5达到平衡状态时,SO2的体积分数是图乙中D、E、F三点中的____________点。A、B两点SO2转化率的大小关系为aA ___(填“>”“<”或“=”)aB。
=1.5达到平衡状态时,SO2的体积分数是图乙中D、E、F三点中的____________点。A、B两点SO2转化率的大小关系为aA ___(填“>”“<”或“=”)aB。
(4)工业上脱硫脱硝还可采用电化学法,其中的一种方法是内电池模式(直接法),烟气中的组分直接在电池液中被吸收及在电极反应中被转化,采用内电池模式将SO2吸收在电池液中,并在电极反应中氧化为硫酸,在此反应过程中可得到质量分数为40%的硫酸。写出通入SO2电极的反应式:____________;若40%的硫酸溶液吸收氨气获得(NH4)2SO4的稀溶液,测得常温下,该溶液的pH=5,则 ___________(计算结果保留一位小数,已知该温度下NH3·H2O的Kb=1.7×10-5);若将该溶液蒸发掉一部分水后恢复室温,则
___________(计算结果保留一位小数,已知该温度下NH3·H2O的Kb=1.7×10-5);若将该溶液蒸发掉一部分水后恢复室温,则 的值将_____(填“变大”“不变”或“变小”)。
的值将_____(填“变大”“不变”或“变小”)。
-
2013年春季,全国各地持续出现严重的雾霾天气,给人们的生产、生活造成了严重的影响。汽车尾气中含有CO、氮氧化物、烟尘等污染物,是导致雾霾天气的原因之一。请回答下列有关问题。
(1)下列说法正确的是________。
A.NO、CO、CO2均为酸性氧化物
B.CO2的大量排放会导致温室效应,所以应尽量选用公共交通,提倡低碳出
行
C.汽车尾气中的氮氧化物主要是空气中的氮气与氧气在高温条件下生成的
(2)为减轻污染,北京为汽车加装了“三效催化净化器”,可将尾气中的CO、NO转化为参与大气循环的无毒混合气体,反应如下:2NO+2CO N2+2CO2,则该反应的化学平衡常数表达式K=________。
N2+2CO2,则该反应的化学平衡常数表达式K=________。
(3)已知下列热化学方程式:
N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ·mol-1①
2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ·mol-1②
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1③
则汽车尾气转化反应2NO(g)+2CO(g) N2(g)+2CO2(g)的ΔH=________。
N2(g)+2CO2(g)的ΔH=________。
(4)当固体催化剂质量一定时,增大其表面积可加快化学反应速率。如图表示在其他条件不变时,反应2NO(g)+2CO(g) N2(g)+2CO2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
N2(g)+2CO2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
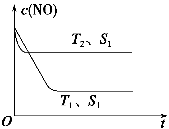
①图中T1________T2(填“>”或“<”)。
②若催化剂的表面积S1>S2,在图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线。
(5)低温脱硝技术可用于处理各种废气中的氮氧化物,发生的化学反应为2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是________。
2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是________。
A.反应中每转移3 mol电子,生成标准状况下N2的体积为22.4 L
B.平衡时,若其他条件不变,增大NH3的浓度,废气中氮氧化物的转化率
减小
C.因为反应物比生成物的物质的量少,所以反应物比生成物的能量低
D.其他条件不变时,使用高效催化剂,废气中氮氧化物的转化率增大
-
近几年,大气污染越来越严重,雾霾天气对人们的生活、出行、身体健康产生许多不利的影响。汽车尾气是主要的大气污染源。降低汽车尾气危害的方法之一是在排气管上安装催化转化器,发生的反应为:
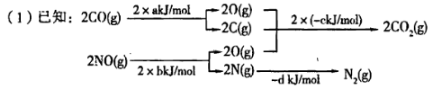
则 ,△H=__________kJ
,△H=__________kJ (用含a、b、c、d的式子表示)。
(用含a、b、c、d的式子表示)。
(2)某温度下,向容积为1L的容器中充人3 mol NO和1 mol CO, NO的转化率随时间的变化如下图所示。
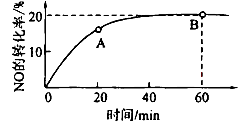
回答下列问题:
①该温度下,化学平衡常数K=___________,平衡时CO的转化率为__________。
②A点的逆反应速率逆 (CO)___________B点的逆反应速率
(CO)___________B点的逆反应速率 (NO)(填“>”、“<”或“=”)。
(NO)(填“>”、“<”或“=”)。
③下列图像正确且能表明在时间T1时刻反应一定处于平衡状态的是__________。
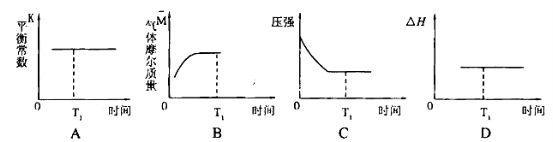
如果该反应达平衡后,降低温度,平衡常数增大,则△H___________0(填“>”、“< ”或“=”)
④达平衡后,将容器的容积扩大一倍,下列说法正确的是
A.平衡向正反应方向移动 B.CO的体积分数增大
C.平衡常数减小 D.一氧化碳的浓度增大
-
雾霾天气频繁出现,严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断试样的pH= 。
(2)汽车尾气中NOx和CO的生成:
①已知汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
2NO(g) △H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
A.混合气体的密度不再变化 B.混合气体的平均分子量不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2 D.氧气的百分含量不再变化
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g),已知该反应的△H>0,则该设想能否实现______________(填“能”或“不能”)
(3)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g) =CO(g)△H =-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。
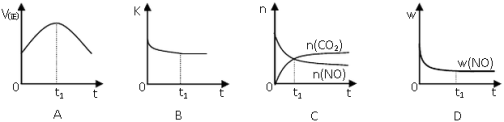
(4)汽车尾气净化的主要原理:2NO(g)+2CO(g) 2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是__(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是__(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(5)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质)。一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
| 物质 温度/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
(1)写出NO与活性炭反应的化学方程式______________________;
(2)计算上述反应T1℃时的平衡常数K1=__________________;若T1<T2,则该反应的△H_0(填“>”、“<”或“=”)。
(3)上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为____________;
-
雾霾天气频繁出现,严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断试样的pH=_________。
(2)汽车尾气中NOx和CO的生成:
①已知汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
2NO(g) △H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
A.混合气体的密度不再变化 B.混合气体的平均分子量不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2 D.氧气的百分含量不再变化
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g),已知该反应的△H>0,则该设想能否实现______________(填“能”或“不能”)
(3)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:
H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g) =CO(g)△H =-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:___________________。
②洗涤含SO2的烟气。
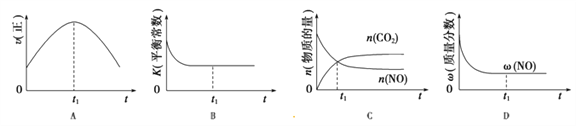
(4)汽车尾气净化的主要原理:2NO(g)+2CO(g) 2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质)。一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
| 物质 温度/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
(1)写出NO与活性炭反应的化学方程式______________________;
(2)计算上述反应T1℃时的平衡常数K1=__________________;若T1<T2,则该反应的△H__________________0(填“>”、“<”或“=”)。
(3)上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为________;
【答案】 4 D 不能 C(s)+H2O(g)=CO(g)+H2(g) △H= +131.3 kJ•mol-1 BD C(s)+2NO(g)=CO2(g)+N2(g) 4 < 80%
【解析】(1)根据表格提供的离子可知,NH4+ 水解导致试样溶液呈酸性,再根据电荷守恒可知,c(K+)+c(NH4+ )+c(Na+)+c(H+)=2c(SO42-)+c(Cl-)+c(NO3-),将表格中的数据代入得H+离子浓度为10-4,则PH值为4。
(2)①在恒容密闭容器中,混合气体的质量和体积始终不变,混合气体的密度也始终不变,密度不能作为达到平衡状态的判据,A项错误;该反应是气体体积不变的可逆反应,根据M=质量/n,则混合气体的平均分子量始终不变,不能作为达到平衡的判据,B项错误;N2、O2、NO的物质的量之比为1∶1∶2不能说明反应各物质的浓度保持不变,C项错误;氧气的百分含量不再变化,说明反应达到平衡状态,D项正确;答案选D。
②化学反应2CO(g)=2C(s)+O2(g)是一个熵减、吸热的反应,则△H-T△S>0,所以该设想不能实现。
(3)已知:①H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1、②C(s)+1/2O2(g) =CO(g) △H =-110.5kJ·mol-1,利用盖斯定律,将②-①可得C(s)+H2O(g)=CO(g)+H2(g)△H=(-110.51kJ•mol-1)-(-241.81kJ•mol-1)=+13l.3 kJ•mol-1,所以焦炭与水蒸气反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g) △H= +131.3 kJ•mol-1 。
(4)可逆反应达化学平衡状态时正逆反应速率不再变化,A项错误;该物质的浓度在化学平衡时保持不变,所以K不再变化,B项正确;对于恒容容器而言,各物质的物质的量不再改变,C项错误;平衡时NO的质量分数不再改变,D项正确,答案选BD。
(5)①由表中数据可知,C、NO、E、F的化学计量数之比为0.040:0.080:0.040:0.040 =1:2:1:1,反应中C被氧化,结合原子守恒可知,生成物为N2与CO2,且该反应为可逆反应,则反应方程式为C(s)+2NO(g) ⇌ CO2(g)+N2(g)。
②从表中数据可知T1℃时的平衡浓度c(NO)=0.004mol/L,c(N2)=c(CO2)=0.008 mol/L,则T1℃时该反应的平衡常数为K1=(0.008×0.008)÷(0.004×0.004)=4;从T1到T2,NO的浓度增大,说明平衡逆向移动,若T1<T2,升高温度,平衡向吸热反应方向移动,则该反应的正向为放热反应,则△H < 0。
③在T1时,K=4,设NO的转化率为x,根据三段式解答:
C(s)+2NO(g) ⇌ CO2(g)+N2(g)
起始浓度 0.04 0 0
变化浓度 0.04x 0.02x 0.02x
平衡浓度 0.04-0.04x 0.02x 0.02x
K=[0.02x×0.02x]÷[(0.04-0.04x)×(0.04-0.04x)=4,解得x=0.8,即达到新的平衡时,NO的转化率为80%。
【题型】填空题
【结束】
10
钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:
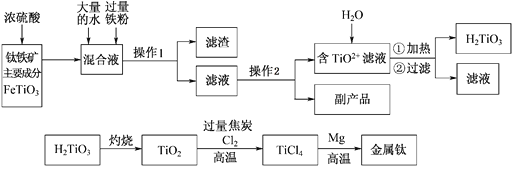
已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,TiOSO4遇水会水解。请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有_________;
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理_______________。
(3)已知钛的还原性介于铝与锌之间。如果可从Na、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是____________。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式是___________________________________。
(5)为测定溶液中TiOSO4的含量,先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。过滤后,取无色滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用______________________(填一种玻璃仪器的名称)滴加0.1000mol·L-1 FeCl3溶液,发生Ti3++Fe3+=Ti4++Fe2+。滴定终点时的现象是___________________________________,若用去了30.00mL FeC13溶液,待测钛液中TiOSO4的物质的量浓度是______________mol/L。
-
雾霾天气频繁出现,严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| | | | | | | |
根据表中数据判断试样的pH=_________。
(2)汽车尾气中NOx和CO的生成:已知汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H>0。恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
2NO(g) △H>0。恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
A.混合气体的密度不再变化 B.容器内的压强不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2 D.氧气的百分含量不再变化
(3)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g) =CO(g)△H =-110.5kJ·mol-1
②洗涤含SO2的烟气。
写出焦炭与水蒸气反应的热化学方程式:_______________。
(4)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质)。一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
| 物质 温度/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式______________________;
②计算上述反应T1℃时的平衡常数K1=______________;
若T1<T2,则该反应的△H__________0(填“>”、“<”或“=”)。
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为________;





 2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是________。
2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是________。

 ,△H=__________kJ
,△H=__________kJ



