-
2SO2(g)+O2(g)
2SO3(g) △H =-198kJ/mol,在V2O5存在时,该反应机理为:V2O5+SO2→2VO3+SO3(快);4VO2+O2→2V2O5(慢)
A. 反应速率主要取决于V2O5的质量 B. VO2是该反应的催化剂
C. 该反应逆反应的活化能大于198kJ/mol D. 升高温度,该反应的△H增大
高三化学单选题中等难度题查看答案及解析
-
已知2SO2(g)+O2(g)⇌2SO3(g) △H=-198kJ⋅mol-1,当有V2O5存在时,该反应机理为:V2O5+SO2→2VO2+SO3(快);4VO2+O2→2V2O5 (慢),下列说法正确的是( )
A.由反应机理可知VO2和V2O5都是该反应的催化剂
B.该反应在高温下易自发进行
C.该反应的逆反应的活化能大于198kJ⋅mol-1
D.当V2O5存在时,加快化学反应速率,△H会减小
高三化学单选题中等难度题查看答案及解析
-
2SO2(g)十O2(g) ⇌ 2SO3(g) △H = -198 kJ·mol-1,在V2O5存在时,该反应机理为:Ⅰ:V2O5+ SO2→2VO2 +SO3(快) Ⅱ: 4VO2+O2→2V2O5(慢),下列说法正确的是
A. 反应速率主要取决于Ⅰ步反应
B. 该反应逆反应的活化能大于198kJ/mol
C. 2molSO2和1molO2在一定条件下充分反应能放出198KJ的热量
D. VO2在反应中起催化剂的作用降低了反应活化能加快反应速率
高三化学单选题中等难度题查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g) △H=-198kJ/mol,在V2O5存在时,该反应机理为:V2O5+SO2→2VO2+SO3(快); 4VO2+O2→2V2O5(慢),下列说法正确的是( )
A.反应速率主要取决于V2O5的质量 B.VO2是该反应的催化剂
C.该反应逆反应的活化能大于198kJ/mol D.升高温度,该反应的△H增大
高三化学单选题中等难度题查看答案及解析
-
2SO2(g)十O2(g)
2SO3(g) △H = -198kJ·mol-1,在V2O5存在时,该反应机理为:
Ⅰ:V2O5+ SO2→2VO2 +SO3(快) Ⅱ: 4VO2+O2→2V2O5(慢),下列说法正确的是( )
A. 反应速率主要取决于Ⅰ步反应
B. 该反应逆反应的活化能大于198kJ/mol
C. 2molSO2和1molO2在一定条件下充分反应能放出198KJ的热量
D. 在恒温、恒容条件下,达到平衡后继续加入少量SO3平衡将向正反应方向移动,所以SO3的体积百分数增大
高三化学单选题中等难度题查看答案及解析
-
已知2SO2(g)+O2(g)
2SO3(g),△H=-198kJ/mol,在 V2O5存在时反应过程中的能量变化如图所示。下列叙述正确的是
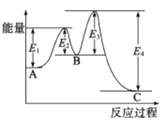
A. △H= E4- E3+E2-E1
B. 加入V2O5后反应经过两步完成,其中第一步决定反应速率
C. 加入V2O5,△H不变,但反应速率改变
D. 向密闭容器中充入2molSO2和1molO2,发生上述反应达平衡时,反应放热198kJ
高三化学单选题中等难度题查看答案及解析
-
2SO2(g)+O2(g)=2SO3(g) ΔH=-198kJ/mol,在V2O5存在时,该反应的机理为:V2O5+SO2
2VO2+SO3(快) 4VO2+O2
2V2O5(慢)
下列说法正确的是
A. 反应速率主要取决于V2O5的质量 B. VO2是该反应的催化剂
C. 逆反应的活化能大于198kJ/mol D. 增大SO2的浓度可显著提高反应速率
高三化学单选题中等难度题查看答案及解析
-
2SO2(g)+O2(g)=2SO3(g) ΔH=-198kJ/mol,在V2O5存在时,该反应的机理为:V2O5+SO2
2VO2+SO3(快) 4VO2+O2
2V2O5(慢)
下列说法正确的是
A. 反应速率主要取决于V2O5的质量 B. VO2是该反应的催化剂
C. 逆反应的活化能大于198kJ/mol D. 增大SO2的浓度可显著提高反应速率
高三化学单选题中等难度题查看答案及解析
-
2SO2(g)十O2(g)=2SO3(g) △H =-198kJ·mol-1,在V2O3存在时,该反应机理为:V2O3+ SO2-→+2VO3+ SO3(快) 4VO2+O2→2 V2O3(慢)。下列说法正确的是
A. 反应速率主要取决于V2O3的质量 B. VO2是该反应的催化剂
C. 该反应逆反应的活化能大于198kJ/mol D. 升高温度,该反应的△H增大
高三化学单选题中等难度题查看答案及解析
-
硫及其化合物对人类的生产和生活有着重要的作用.
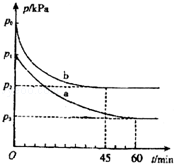
2SO2(g)+O2(g)⇌2SO3(g)△H=﹣198kJ•mol﹣1是制备硫酸的重要反应.
(1)在容积为V L的密闭容器中起始充入2mol SO2和1mol O2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示.与实验a相比,实验b改变的条件是 ,判断的依据 .
(2)二氧化硫在一定条件下还可以发生如下反应:
SO2(g)+NO2(g)⇌SO3(g)+NO(g)△H=﹣42kJ•mol﹣1.
在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
实验编号
温度
起始时物质的量/mol
平衡时物质的量/mol
N(SO2)
N(NO2)
N(NO)
甲
T1
0.80
0.20
0.18
乙
T2
0.20
0.80
0.16
丙
T3
0.20
0.30
a
①实验甲中,若2min时测得放出的热量是4.2kJ,则0~2min时间内,用SO2(g)表示的平均反应速率v(SO2)= ,该温度下的平衡常数 .
②实验丙中,达到平衡时,NO2的转化率为 .
③由表中数据可推知,Tl T2(填“>”“<’’或“=”),判断的理由是 .
高三化学填空题困难题查看答案及解析