-
NA为阿伏伽德罗常数的值,下列叙述正确的是
A. 4.0g由H218O与D216O组成的混合物中所含中子数为2NA
B. 标准状况下,22.4 L己烷含有的共价键数目为19 NA
C. 1L pH=13的NaOH溶液中含有OH-的数目一定为0.1 NA
D. 1mol的 Na2O和BaO2混合物中含有的阴、阳离子总数为3NA
难度: 中等查看答案及解析
-
下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
选项
陈述Ⅰ
陈述Ⅱ
判断
A
碳酸钠溶液可用于治疗胃病
Na2CO3可与盐酸反应
Ⅰ对,Ⅱ对,有
B
向Na2O2的水溶液中滴入酚酞变红色
Na2O2与水反应生成氢氧化钠
Ⅰ对,Ⅱ错,无
C
金属钠保存在煤油中,以隔绝空气
常温下,金属钠在空气中会生成过氧化钠
Ⅰ对,Ⅱ对,有
D
过氧化钠可用于航天员的供氧剂
Na2O2能和CO2、H2O反应生成O2
Ⅰ对,Ⅱ对,有
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A. 硫化氢气体通入氯水中:H2S+Cl2=S↓+2Cl-+2H+
B. 向小苏打溶液中加入过量的石灰水:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
C. 氟气通入水中: 2F2+2H2O=4F-+4H++O2
D. FeBr2溶液与足量的Cl2反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
难度: 困难查看答案及解析
-
有下列三个反应:
①Cl2+FeI2=FeCl2+I2
②2Fe2++Br2=2Fe3++2Br-
③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
下列说法正确的是( )
A. 反应①②③中的氧化产物分别是I2、Fe3+、CoCl2
B. 根据以上方程式可以得到氧化性:Cl2>Fe3+>Co2O3
C. 在反应③中当1 mol Co2O3参加反应时,2 mol HCl被氧化
D. 可以推理得到Cl2+FeBr2 =FeCl2+Br2
难度: 中等查看答案及解析
-
一种新型的电池,总反应为: 3Zn+2FeO42-+8H2O=2Fe(OH)3↓+3Zn(OH)2↓+4OH—,其工作原理如图所示。下列说法不正确的是
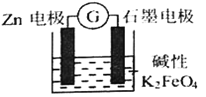
A. Zn极是负极,发生氧化反应
B. 随着反应的进行,溶液的pH增大
C. 电子由Zn极流出到石墨电极,再经过溶液回到Zn极,形成回路
D. 石墨电极上发生的反应为:FeO42—+3e—+4H2O=Fe(OH)3↓+5OH—
难度: 中等查看答案及解析
-
对下列两种有机物的描述正确的是
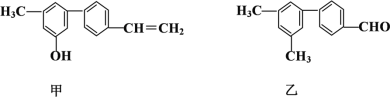
A. 苯环上的一氯代物种数相同
B. 分子中共面的碳原子数一定相同
C. 1 mol甲与浓溴水反应最多能消耗4 mol Br2
D. 甲、乙可用红外光谱区分,但不能用核磁共振氢谱区分
难度: 中等查看答案及解析