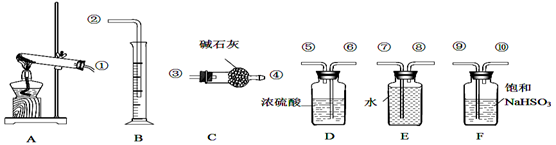
-
十八大报告中提出“大力推进生态文明建设,提高生态文明水平,建设美丽中国”。化学已渗透到人类生活的各个方面。下列说法正确的是
A.PM2.5是指大气中直径≤2.5微米的颗粒物,只要戴普通口罩就对人体健康无影响
B.垃圾是放错地方的资源,应分类回收利用
C.高纯度的硅单质广泛用于制作光导纤维,光导纤维是新型高分子非金属结构材料
D.地沟油的主要成分是高级脂肪酸甘油酯,可用于制肥皂和加工食用油
难度: 中等查看答案及解析
-
下列说法正确的是
A.电解质溶液能导电,是因为在通电时电解质电离产生了自由移动的离子
B.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH值不变
C.将AlCl3溶液和Na2SO3溶液分别蒸干并灼烧,得到Al2O3和Na2SO3
D.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液,则溶液浓度大小关系:
c(CH3COONa)> c(Na2CO3)> c(C6H5ONa)>c(NaOH)
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.将过量的NaOH溶液滴入同浓度的少量Ca(HCO3)2溶液中Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全Ba2++OH-+H++ SO42-=BaSO4↓+H2O
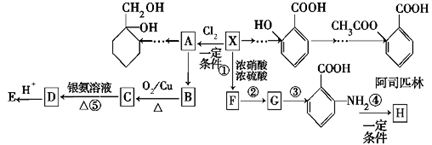
C.服用阿司匹林过量出现水杨酸(
)反应,可静脉注滴NaHCO3溶液:
+ 2 HCO3- →
+ 2 CO2↑ + 2 H2O
D.向FeI2溶液中加少量氯水 2Fe2++Cl2=2Fe3++2Cl-
难度: 中等查看答案及解析
-
若NA为阿伏加德罗常数的值,下列说法正确的是
A.NA个Fe(OH)3胶体粒子的质量为107g
B.8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA
C.标准状况下,将2.24L Cl2溶于水,可得到HClO分子的数目是0.1NA
D.2.3gNa与氧气完全反应,反应中转移的电子数介于0.1NA到0. 2NA之间
难度: 中等查看答案及解析
-
关于下列各图的叙述,正确的是

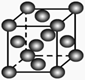


甲 乙 丙 丁
A.甲表示H2与O2发生反应过程中的能量变化,则H2的烧热为483.6kJ·mol-1
B.乙表示Cu形成金属晶体时的堆积方式
C.丙装置中烧杯a中的溶液pH降低
D.丁装置中待镀铁制品应与电源正极相连
难度: 中等查看答案及解析
-
绿原酸的结构简式如图,下列有关绿原酸的说法不正确的是
A.分子式为C16H18O9
B.能与Na2CO3反应
C.能发生取代反应和消去反应
D.0.1 mol绿原酸最多与0.8 mol NaOH反应
难度: 中等查看答案及解析
-
某温度下,H2(g)+CO2(g)
H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确的是
起始浓度
甲
乙
丙
c(H2)/mol·L-1
0.010
0.020
0.020
c(CO2)/mol·L-1
0.010
0.010
0.020
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
难度: 中等查看答案及解析