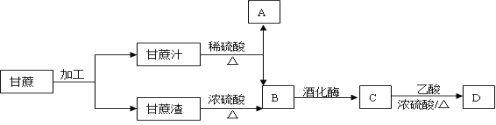
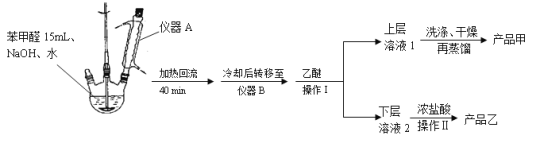
-
下列关于反应速率的说法中,不正确的是
A. 反应速率用于衡量化学反应进行的快慢
B. 决定反应速率的主要因素有浓度、压强、温度和催化剂
C. 可逆反应达到化学平衡时,正、逆反应的速率都不为0
D. 增大反应物浓度、提高反应温度都能增大反应速率
难度: 简单查看答案及解析
-
下列物质中属于盐的是
A. MgO B. H2SO4 C. NaOH D. KNO3
难度: 简单查看答案及解析
-
仪器名称为“蒸发皿”的是
A.
B.
 C.
C. D.
难度: 简单查看答案及解析
-
下列物质属于电解质且能导电的是
A. 石墨 B. 液态HCl C. 葡萄糖 D. 熔融的Na2CO3
难度: 简单查看答案及解析
-
Fe2O3+3CO
2Fe+3CO2的反应类型是
A. 化合反应 B. 置换反应 C. 氧化还原反应 D. 复分解反应
难度: 简单查看答案及解析
-
下列物质的水溶液因水解而呈酸性的是
A. HCl B. CH3COONa C. FeCl3 D. SO2
难度: 简单查看答案及解析
-
化学知识在生产和生活中有着重要的应用。下列说法中不正确的是
A. SiO2通常用于通讯行业
B. 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔;而碳酸钠可作医疗上治疗胃酸过多的一种药剂
C. 明矾可用作净水剂
D. 金属钠可用于冶炼钛等金属
难度: 简单查看答案及解析
-
下列表述正确的是
A. 硫离子的结构示意图:
B. 乙烯的结构简式为CH2CH2
C. 过氧化氢的电子式:
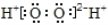 D. H2O分子的比例模型
D. H2O分子的比例模型难度: 中等查看答案及解析
-
有关硫及其化合物说法正确的是
A. 有浓硫酸参与的反应都是氧化还原反应
B. 硫在足量空气中燃烧生成大量SO3
C. SO2能使酸性高锰酸钾溶液褪色,体现了漂白性
D. 二氧化硫可用于抑制酒类中细菌生长,可在葡萄酒中微量添加
难度: 简单查看答案及解析
-
下列说法正确的是
A. 在配制一定物质的量浓度溶液的实验中量筒是必需仪器
B. 实验室中,盛装NaOH 溶液的试剂瓶用橡皮塞
C. 某未知液中加稀NaOH溶液,没有产生使湿润的红色石蕊试纸变蓝的气体,则该未知液中不含NH4+
D. 用pH试纸测定某溶液的pH时,需预先用蒸馏水湿润pH 试纸
难度: 中等查看答案及解析
-
下列说法正确的是
A. H2O与D2O互为同位素 B. 纤维素与淀粉互为同分异构体
C. 干冰和冰为同一种物质 D. 甲烷和十六烷互为同系物
难度: 简单查看答案及解析
-
下列说法正确的是
A. 煤、石油、天然气均为化石燃料,它们属于可再生能源
B. 大自然利用太阳能最成功的是植物的光合作用
C. 石油的分馏、催化裂化、裂解等石油加工方法,其目的均为得到更多的汽油
D. 化肥的大量使用不会造成环境污染
难度: 简单查看答案及解析
-
实现下列转化的反应方程式中,正确的是
A. H2SO3→H2SO4: H2SO3+H2O2=H2SO4+H2O
B. Fe→Fe3+: 2Fe+6H+=2Fe3++3H2↑
C. Br−→Br2: 2Br−+I2=Br2+2I−
D. Cu→CuSO4: Cu+2H2SO4(稀)=CuSO4+SO2↑+2H2O
难度: 简单查看答案及解析
-
下图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说法不正确的是
A. 元素X的最高价氧化物对应水化物的化学式为H3PO4
B. 元素Y有两种常见的氧化物且都能与元素R的氢化物反应生成对应价态的酸
C. R、X、Y三者的气态氢化物稳定性依次增强
D. Z的单质能与Y的某些化合物发生置换反应
难度: 简单查看答案及解析
-
苯环结构中不存在碳碳双键,而是一种介于单键和双键之间的结构,下列不可以作为事实依据的是
A. 苯不能使酸性KMnO4溶液褪色
B. 苯不能使溴水因发生化学反应而褪色
C. 苯在加热和有催化剂存在条件下与H2反应生成环己烷
D. 邻二氯苯只有一种结构
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 乙烯在空气中燃烧时有黑烟,因此可以用燃烧法区别甲烷和乙烯
B. 苯与浓硝酸在浓硫酸存在条件下加热发生取代反应
C. 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质发生变性
D. 氨基酸能够以不同数目和顺序相结合形成结构复杂的多肽
难度: 简单查看答案及解析
-
某原电池装置如右图所示,下列有关说法不正确的是
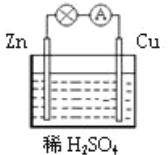
A. 锌是该电池的负极
B. 锌电极上发生氧化反应
C. 铜电极的电极反应式为:2H++2e-=H2↑
D. 若将电解质溶液换成AgNO3溶液,两电极的反应式均发生改变
难度: 中等查看答案及解析
-
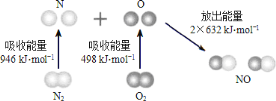
一定条件下,反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ΔH=-a kJ·mol-1 在5 L密闭容器中进行,10 s时,水蒸气的物质的量增加了0.60 mol。则下列说法不正确的是( )
A. 10 s内,NH3的平均反应速率为0.008 mol·L-1·s-1
B. 该反应达到平衡时6v正(O2)=5v逆(H2O)
C. 10 s内,反应放出的热量为0.1a kJ
D. 10 s时,H2O的反应速率为0.012 mol·L-1·s-1
难度: 中等查看答案及解析
-
反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)下列示意图中,能正确表示总反应过程中能量变化的是( )
A.
 B.
B. 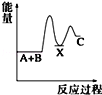
C.
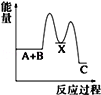 D.
D. 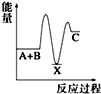
难度: 中等查看答案及解析
-
下列说法正确的是
A. 碘单质的升华过程中,只需克服分子间作用力
B. 金刚石和足球烯(C60)均为原子晶体
C. 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成
D. NH4Cl属于离子化合物,该物质中只存在离子键
难度: 简单查看答案及解析
-
25℃时,甲、乙两烧杯分别盛有5mLpH=1的盐酸和硫酸,下列描述中不正确的是
A. 物质的量浓度:c甲=2c乙
B. 水电离出的OH-浓度:c(OH-)甲=c(OH-)乙
C. 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲=乙
D. 将甲、乙烧杯中溶液混合后(不考虑体积变化),所得溶液的pH>1
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 1 L 1 mol·L-1的盐酸中含HCl分子的数目为NA
B. 1 mol Cl2与足量的铁反应转移的电子数是3NA
C. 常温常压下,15 g乙烷分子中含有的共价键数目为3.5NA
D. 标准状况下,4.48 L重水(D2O)中含有的中子数为2NA
难度: 中等查看答案及解析
-
常温下向20 mL 0.1 mol/L HA溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中不正确的是

A. 由题可知HA为弱酸
B. 滴定终点位于c和d之间
C. 滴定到b点时:n(Na+)+ n(H+)-n(OH-)+ n(HA)=0.002 mol
D. 滴定到d点时:c(OH-)>c(Na+)>c(A-) >c(H+)
难度: 中等查看答案及解析
-
已知还原性Iˉ>Fe2+>I2,在水溶液中I2可被Cl2氧化为IO3ˉ。向含溶质a mol的FeI2溶液中通入b mol Cl2,充分反应(不考虑单质与水的反应,)。下列说法 不正确的是
A. 当a=2b时,反应后的离子浓度之比:c(Fe2+)∶c(Iˉ) ∶c(Clˉ)=1∶1∶1
B. 当3a=2b时,发生的离子反应:2Fe2++4Iˉ+3Cl2=2Fe3++2I2+6Clˉ
C. 当13a=2b时,发生的离子反应为:2Fe2++4I-+13Cl2+ 12H2O =4IO3- +26Cl-+2Fe3++24H+
D. 若反应后溶液中I2与IO3ˉ的物质的量为1:1,则反应中转移电子3.5bmol
难度: 困难查看答案及解析
-
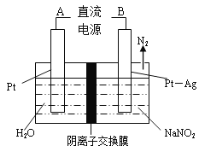
某溶液中可能含有下列6种离子中的某几种: Cl-、SO42-、HCO3-、Na+、K+、Mg2+,所含离子的浓度均相等。为了确认溶液的组成,进行了如下实验:
取200ml上述溶液,加入足量Ba(OH)2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.88g。向沉淀中加入过量的盐酸,有2.33g沉淀不溶。关于原溶液组成的结论,不正确的是
A. 一定存在SO42-、HCO3-、Mg2+,至少存在Na+、K+中的一种
B. 为了确定是否存在Cl-,可向溶液中加入硝酸酸化的硝酸银溶液
C. c(HCO3-)=0.05mol/L
D. 4.88g沉淀中含有3种成分
难度: 困难查看答案及解析