-
NA代表阿伏加德罗常数的值。下列说法正确的是( )
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 22.4 L(标准状况)NH3含有的质子数为18NA
C. 常温常压下,16 g O2和O3混合物中含氧原子数目为NA
D. 密闭容器中,2 mol SO2和1 mol O2充分反应后分子总数为2NA
难度: 中等查看答案及解析
-
下列物质分类正确的是
A. SO2、SiO2、NO2均为酸性氧化物
B. 盐酸、水玻璃、氨水均为混合物
C. 烧碱、冰醋酸、蔗糖均为电解质
D. 稀豆浆、鸡蛋清溶液、氯化铁溶液均为胶体
难度: 中等查看答案及解析
-
(题文)下列有关化学用语的表述正确的是( )
A. 次氯酸的电子式为:
B. 质子数为35、中子数为45的溴原子:
C. He不含共价键,所以不属于分子晶体
D. H2O与D2O含有相同的电子数
难度: 中等查看答案及解析
-
下列实验设计及其对应的离子方程式均正确的是( )
A. 将稀硫酸加入到大苏打溶液中:S2O32-+2H+=S↓+SO2↑+H2O
B. 用铁为电极电解饱和食盐水:2Cl-+2H2O
Cl2↑+H2↑+2OH-
C. Ca(C1O)2溶液中通入少量SO2气体:Ca2++2C1O-+SO2+H2O=CaSO3↓+2HC1O
D. 用浓盐酸酸化的KMnO4溶液与H2C2O4反应,反应的离子方程式为:2MnO4—+6H++5H2C2O4=2Mn2+ +10CO2↑ +8H2O
难度: 中等查看答案及解析
-
已知有如下氧化还原反应:Zn+2HNO3+NH4NO3=N2↑+Zn(NO3)2+3H2O,则下列说法错误的是( )
A. Zn、NH4NO3都是反应的还原剂
B. N2既是氧化产物又是还原产物
C. 该氧化还原反应转移了5e-
D. 若产生N2的体积为2.24 L,则反应中转移的电子数为0.5NA
难度: 中等查看答案及解析
-
下列事实不能说明非金属性Cl﹥I的是( )
A. Cl2+2I-=2Cl-+I2 B. KClO3+I2=KIO3+Cl2 C. 酸性:HClO4﹥HIO4 D. 氧化性:Cl2﹥I2
难度: 中等查看答案及解析
-
下列物质性质的变化规律,与化学键的强弱无关的是( )
A. F2、Cl2、Br2、I2的熔点、沸点逐渐升高 B. HF、HCl、HBr、HI的热稳定性依次减弱
C. 金刚石的硬度、熔点、沸点都高于晶体硅 D. NaF、NaCl、NaBr、NaI的熔点依次降低
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 化学反应中一定伴随能量变化
B. 甲烷燃烧是将全部的化学能转化为热能
C. 物质所含化学键键能越大,其越稳定
D. 大量燃烧煤炭等化石燃料是造成雾霾天气的重要原因
难度: 简单查看答案及解析
-
一定条件下,下列不能用勒夏特列原理解释的是( )
A. 合成氨时将氨液化分离,可提高原料的利用率
B. H2、I2、HI 混合气体加压后颜色变深
C. 实验室常用排饱和NaCl溶液的方法收集Cl2
D. 新制氯水中,滴加硝酸银溶液,溶液颜色变浅,产生白色沉淀
难度: 中等查看答案及解析
-
由反应物 X 分别转化为 Y 和 Z 的能量变化如图所示。下列说法正确的是( )

A. 由 X→Z 反应的 ΔH<0
B. 由 X→Y 反应的 ΔH=E5-E2
C. 增大压强有利于提高 Y 的产率
D. 升高温度有利于提高 Z 的产率
难度: 中等查看答案及解析
-
在通常条件下,下列各组物质的性质排列正确的是( )
A. Na、Mg、Al的第一电离能逐渐增大 B. O、F、N的电负性逐渐增大
C. S2﹣、Cl﹣、K+的半径逐渐增大 D. 热稳定性:HF>H2O>PH3
难度: 中等查看答案及解析
-
不久前,美国一个海军航空站安装了一台250kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600℃﹣700℃,所用燃料为H2,电解质为熔融的K2CO3,已知该电池的总反应为2H2+O2═2H2O,负极反应为H2+CO32﹣-2e﹣═H2O+CO2,则下列推断正确的是( )
A. 正极反应为:O2+2H2O+4e﹣═4OH﹣ B. 电池供应1mol水蒸气,转移电子4mol
C. 放电时CO32﹣向负极移动 D. 放电时正极发生氧化反应
难度: 中等查看答案及解析
-
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)
2C(g) ΔH>0,其他条件不变化,只有温度变化时,某量随温度变化的关系如图所示。则下列说法中,正确是( )
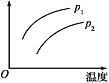
A. 若p1>p2,纵坐标表示A的质量分数 B. 若p1<p2,纵坐标表示C的质量分数
C. 若p1>p2,纵坐标表示混合气体的平均摩尔质量 D. 若p1<p2,纵坐标表示A的转化率
难度: 困难查看答案及解析
-
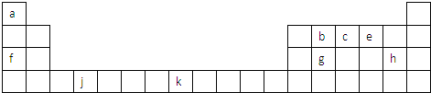
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是
A. 原子半径:X<Y<Z
B. 气态氢化物的稳定性:X>Z
C. 非金属性:Y>Z
D. 最高价氧化物对应水化物的酸性:W>Y
难度: 中等查看答案及解析
-
验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
①
②
③
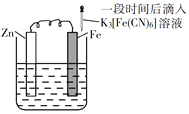
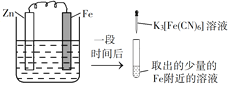
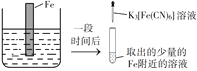
在Fe表面生成蓝色沉淀
试管内无明显变化
试管内生成蓝色沉淀
下列说法不正确的是
A. 对比②③,可以判定Zn保护了Fe
B. 对比①②,K3[Fe(CN)6]可能将Fe氧化
C. 验证Zn保护Fe时不能用①的方法
D. 将Zn换成Cu,用①的方法可判断Fe比Cu活泼
难度: 困难查看答案及解析
-
在密闭容器中发生下列反应 aA(g)
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是
A. A的转化率变小 B. 平衡向正反应方向移动
C. D的物质的量变多 D. a>c+d
难度: 中等查看答案及解析
-
已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大。I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)
I3-(aq)。测得不同温度下该反应的平衡常数如下图所示,下列说法正确的是( )

A. 反应I2(aq)+I-(aq)
I3 -(aq)的ΔH>0
B. 利用该反应可以除去硫粉中少量的碘单质
C. 在上述平衡体系中加入CCl4,平衡不移动
D. 25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680
难度: 中等查看答案及解析
-
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法中不正确的是
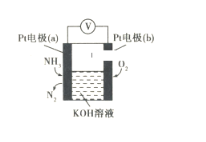
A. 溶液中OH-向a极移动
B. O2在b极上发生还原反应
C. 负极的电极反应式为:2NH3-6e-+60H-=N2+6H2O
D. 反应消耗的NH3与O2的物质的量之比为4:5
难度: 中等查看答案及解析
-
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g) + Y(g)
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表:
t /min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
下列说法正确的是
A. 反应前2min的平均速率v(Z) =4.0×10-3mol/(L•min)
B. 其他条件不变,降低温度,反应达到新平衡前v(逆) > v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 中和等体积等浓度的醋酸和盐酸,醋酸需要的氢氧化钠溶液更多
B. pH=3的醋酸溶液,稀释至10倍后pH=4
C. pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH>7
D. pH均为3的醋酸和盐酸分别与足量Zn反应,醋酸产生的H2多
难度: 中等查看答案及解析