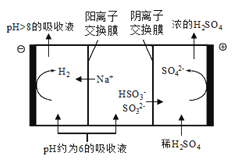
-
下列能量的转化过程中,由化学能转化为电能的是
A
B
C
D




铅蓄电池放电
风力发电
水力发电
太阳能发电
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列化学用语正确的是
A. HSO3-+ H2O
SO32- + OH- B. Al3+ + 3H2O == 3H+ + Al(OH)3↓
C. NaHCO3 == Na+ + HCO3- D. H2S
2H+ + S2-
难度: 困难查看答案及解析
-
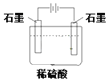
下列关于金属腐蚀与防护的说法不正确的是

图① 图② 图③
A. 图①,放置于干燥空气中的铁钉不易生锈
B. 图②,若断开电源,钢闸门将发生吸氧腐蚀
C. 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀
D. 图③,若金属M比Fe活泼,可防止输水管腐蚀
难度: 中等查看答案及解析
-
下列溶液一定呈中性的是( )
A. pH=7的溶液 B. c(H+)=c(OH-)=10-6mol/L的溶液
C. 使酚酞试液呈无色的溶液 D. 酸与碱恰好完全反应生成正盐的溶液
难度: 中等查看答案及解析
-
如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述不正确的是
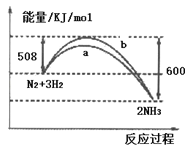
A. 在温度、体积一定的条件下,通入1mol N2和3mol H2 反应后放出的热量为92kJ
B. a曲线是加入催化剂时的能量变化曲线
C. 加入催化剂,也不能提高N2的转化率
D. 该反应的热化学方程式为:N2(g)+3H2(g)
2NH3(g) △H=﹣92 kJ/mol
难度: 中等查看答案及解析
-
下列实验事实不能用平衡移动原理解释的是
A. pH=11的氨水稀释10倍后溶液pH>10
B. 将氯化铝溶液加热蒸干并灼烧,最终得氧化铝固体
C. 对2HI(g)
H2(g)+I2(g),减小容器体积,气体颜色变深
D. 水垢中含有CaSO4,可先用Na2CO3溶液浸泡处理,而后用盐酸去除
难度: 中等查看答案及解析
-
以下是常温下几种弱酸的电离平衡常数:
CH3COOH
H2S
HClO
K=1.8×10-5
K1=1.3×10-7
K2=7.1×10-15
K=4.69×10-11
下列说法正确的是
A. 可发生反应:H2S+ 2ClO-=S2-+ 2HClO
B. CH3COOH溶液与Na2S溶液不能反应生成NaHS
C. 同物质的量浓度的Na2S、NaClO、CH3COONa溶液,pH最大的是NaClO溶液
D. 同物质的量浓度的H2S、HClO、CH3COOH溶液,酸性最强的是CH3COOH
难度: 中等查看答案及解析
-
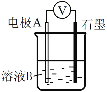
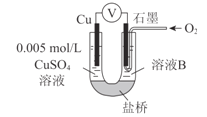
下列说法正确的是
A
B
C
D
通电一段时间后,搅拌均匀,溶液的pH增大
此装置可实现
铜的精炼
盐桥中的K+
移向FeCl3溶液
若观察到甲烧杯中石墨电极附近先变红,则乙烧杯中铜电极为阳极
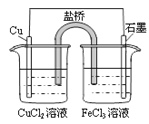
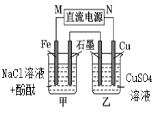
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
为研究沉淀的生成及其转化,某小组进行如下实验。关于该实验的分析不正确的是
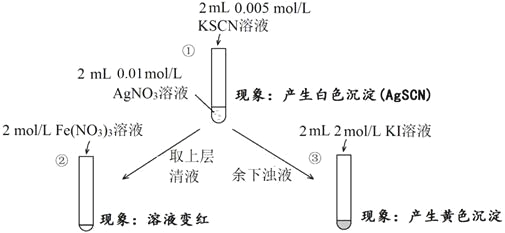
A. ①浊液中存在平衡:AgSCN(s)
Ag+(aq)+SCN-(aq)
B. ②中颜色变化说明上层清液中含有SCN-
C. ③中颜色变化说明有AgI生成
D. 该实验可以证明AgI比AgSCN更难溶
难度: 中等查看答案及解析
-
K2FeO4在水中不稳定,发生反应:4FeO42-+10H2O
4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如图所示。下列说法不正确的是
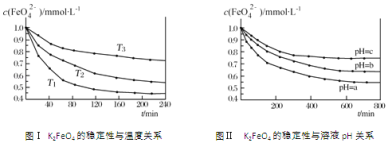
A. 由图Ⅰ可知K2FeO4的稳定性随温度的升高而减弱
B. 由图Ⅱ可知图中a>c
C. 由图Ⅰ可知温度:T1>T2>T3
D. 由图Ⅰ可知上述反应△H>0
难度: 中等查看答案及解析
-
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下: 电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3O2
Al2O3+3H2↑电解过程中,以下判断正确的是( )
电池
电解池
A
H+移向Pb电极
H+移向Pb电极
B
每消耗3molPb
生成2molAl2O3
C
正极:PbO2+4H++2e—=Pb2++2H2O
阳极:2Al+3H2O-6e—=Al2O3+6H+
D
难度: 简单查看答案及解析
-
常温下,用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L HCl溶液,滴定曲线如图所示,下列说法不正确的是
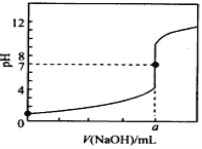
A. a=20.00
B. 滴定过程中,可能存在:c(Cl-)>c(H+)>c(Na+)>c(OH-)
C. 若将盐酸换成相同浓度的醋酸,则滴定到pH=7时,a<20.00
D. 若用酚酞作指示剂,当滴定到溶液明显由无色变为浅红色时立即停止滴定
难度: 中等查看答案及解析
-
下列选项中,微粒的物质的量浓度关系正确的是
A. 0.1 mol/L K2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
B. 0.1 mol/L NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
C. 等物质的量的一元弱酸HX与其钾盐KX的混合溶液中:2c(K+)= c(HX)+c(X-)
D. 浓度均为0.1 mol/L的NaHCO3溶液和NaOH溶液等体积混合:c(Na+)+ c(H+)=c(CO32-)+c(OH-)+c(HCO3-)
难度: 困难查看答案及解析
-
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是
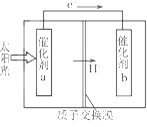
A. 该过程是将太阳能转化为化学能的过程
B. 催化剂a表面发生氧化反应,有O2产生
C. 催化剂a附近酸性减弱,催化剂b附近酸性增强
D. 催化剂b表面的反应是CO2+2H++2e一=HCOOH
难度: 中等查看答案及解析
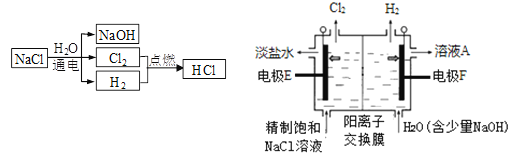
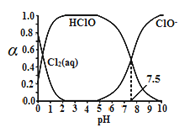

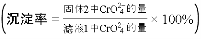 ,
,