-
近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:

(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) △H1=+551kJ•mol-1
反应Ⅲ:S(g)+O2(g)=SO2(g) △H3=-297 kJ•mol-1
反应Ⅱ的热化学方程式:____________________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如右图所示,p2______p1(填“>”或“<”),得出该结论的理由是__________。

(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下,将ii补充完整
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+______=______+______+2I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mLSO2饱和溶液加入到2mL下列试剂中,密闭放置观察现象,(已知:I2易溶解在KI溶液中)
| 序号 | A | B | C | D |
| 试剂组成 | 0.4 mol•L-1 KI | amol•L-1 KI 0.2mol•L-1H2SO4 | 0.2mol•L-1H2SO4 | 0.2 mol•L-1 KI 0.0002 molI2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
① B是A的对比实验,则a=______。
②比较A、B、C,可得出的结论是______。
③实验表明,SO2的歧化反应速率D>A.结合i,ii反应速率解释原因:______。
-
近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:________________________________。
(2)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+_________=_________+_______+2 I-_____________
(3)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
| 序号 | A | B | C | D |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=__________。
②比较A、B、C,可得出的结论是______________________。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________。
-
近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
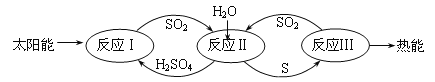
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ΔH=+550 kJ·mol-1
它由两步反应组成:i. H2SO4(l)=SO3(g)+H2O(g) ΔH=+177 kJ·mol-1 ii. SO3(g)分解。
L(L1、L2)、X可分别代表压强和温度。下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。

① X代表的物理量是_____________________。
② 判断L1、L2的大小关系是______________。
(2)反应Ⅱ:I-可以作为催化剂,可能的催化过程如下。
i. SO2+4I-+4H+=S↓+2I2+2H2O; ii. I2+2H2O+ SO2= SO42-+4H++2I-;
探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
| 序号 | A | B | C | D |
| 试剂组成 | 0.4 mol/L KI | a mol/LKI 0.2 mol/LH2SO4 | 0.2 mol/L H2SO4 | 0.2 mol/L KI 0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
① B是A的对比实验,则a=__________。
② 比较A、B、C,可得出的结论是_______________________________。
③ 实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:___________。
(3)在钠碱循环法中,Na2SO3溶液作为吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
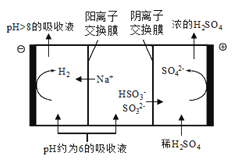
① 上表判断NaHSO3溶液显__________性,用化学平衡原理解释:_____________。
② HSO3-在阳极放电的电极反应式是______,当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理________。
-
(6分)氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:

反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550 kJ·mol-1
它由两步反应组成:i.H2SO4(l)=SO3(g)+H2O(g) △H=+177 kJ·mol-1
ii.SO3(g)分解。
L(L1、L2)、X可分别代表压强和温度。下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。
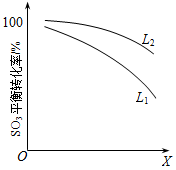
①X代表的物理量是 。
②判断L1、L2的大小关系,L1 L2
并简述理由: 。
-
能源是当今社会发展的三大支柱之一。有专家提出:如果对燃料燃烧产物如二氧化碳、水、氮气等能够实现利用太阳能让它们重新组合(如下图),可以节约燃料,缓解能源危机。在此构想的物质循环中太阳能最终转化为
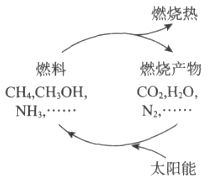
A. 化学能
B. 热能
C. 生物能
D. 电能
-
利用太阳能热化学硫碘循环分解水制氢反应过程如下图所示:
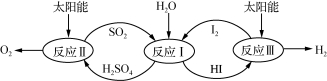
(1) 反应Ⅱ中涉及的热化学方程式为:
①H2SO4(l)=SO3(g)+H2O(g) ΔH=+177.3 kJ·mol-1
②2SO3(g) = 2SO2(g)+O2(g) ΔH=a kJ·mol-1
③2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ΔH=+550.2 kJ·mol-1则 a= ;
(2)反应Ⅰ得到的产物可用I2进行分离。该产物的溶液在过量I2的存在下会分成两层 :含低浓度I2的H2SO4溶液层和高浓度的I2的HI溶液层。
①区分两层溶液可加入的试剂为 (填化学式)。
②下列说法正确的是 (填序号)。
A. SO2在反应Ⅰ中作氧化剂
B. 加过量I2前,H2SO4溶液和HI不互溶
C. 两层溶液的密度存在差异
D. I2在HI溶液中比在H2SO4溶液中易溶
(3)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O也可制H2,其物质转化如右图所示。
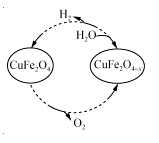
①氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式为 。
②若x=0.15,则1 mol CuFe2O4参与该循环过程理论上一次能制得标准状况下的H2体积为 L。
③CuFe2O4可用电化学方法得到,其原理如图所示, 则阳极的电极反应式为 。
则阳极的电极反应式为 。

-
中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如下图所示。下列说法不正确的是
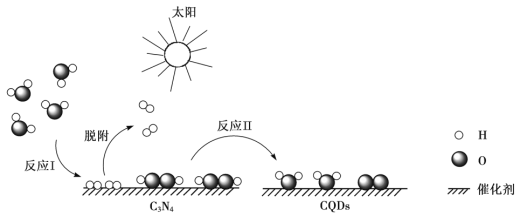
A. 通过该催化反应,实现了太阳能向化学能的转化
B. 反应I中涉及到非极性键的断裂和极性键的形成
C. 反应II为:2H2O2  2H2O + O2↑
2H2O + O2↑
D. 总反应为:2H2O 2H2↑+ O2↑
2H2↑+ O2↑
-
下图是利用太阳能实现燃烧产物重新组合的构想,可以节约燃料,缓解能源危机。 在此构想的物质循环中太阳能最终转化为
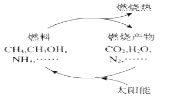
A.热能 B.生物能 C.化学能 D.电能
-
中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
| 化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
| 键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应
-
中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
| 化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
| 键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应















