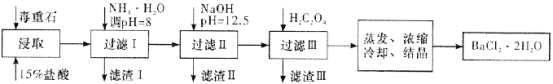
-
下列实验操作或装置符合实验要求的是
装置Ⅰ
装置Ⅱ
装置Ⅲ
装置Ⅳ


A. 装置Ⅰ用滴定法测定盐酸的浓度
B. 装置Ⅱ可用于中和热的测定
C. 装置Ⅲ可用于验证化学能转化为电能
D. 装置Ⅳ可合成氨并检验氨气的生成
难度: 简单查看答案及解析
-
已知:① 2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1②H2(g)+S(g)=H2S(g) ΔH=-20.1 kJ·mol-1。
下列判断正确的是( )
A. 1 mol氢气完全燃烧生成液态水吸收热量241.8 kJ
B. 1 mol H2O(g)和1 mol H2S(g)的能量相差221.7 kJ
C. 由①②知,水的热稳定性小于硫化氢
D. 若反应②中改用固态硫,1 mol S(s)完全反应,放出的热量小于20.1 kJ
难度: 中等查看答案及解析
-
下列无色透明溶液中能大量共存的离子组是
A. Na+、Al3+、HCO3-、NO3-
B. OH-、Cl-、Mg2+、K+
C. NH4+、Na+、CH3COO-、NO3-
D. Na+、NO3-、Fe3+、I-
难度: 简单查看答案及解析
-
下列过程一定不能自发进行的是
A. 2N2O5(g)=4NO2(g)+O2(g);ΔH>0
B. 2CO(g)=2C(s)+O2(g);ΔH>0
C. (NH4)2CO3(s)=NH4HCO3(s)+NH3(g);ΔH>0
D. 2H2(g)+O2(g)=2H2O(l);ΔH<0
难度: 简单查看答案及解析
-
在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)
2C(g) ΔH<0。达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是

X
Y
A
再加入A
B的转化率
B
再加入C
A的体积分数
C
减小压强
A的转化率
D
升高温度
混合气体平均摩尔质量
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知水的电离方程式:H2O
H+ + OH-,下列叙述中正确的是
A. 升高温度,KW增大,pH不变
B. 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
C. 向水中加入少量硫酸,c(H+)增大,KW不变
D. 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
难度: 简单查看答案及解析
-
下列事实中,与电化学腐蚀无关的是
A.镀锡的铁制品,镀层部分受损后,露出的铁表面易被腐蚀
B.在空气中,光亮的银器表面逐渐变暗
C.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
D.为保护海轮的船壳,常在船壳上镶入锌块
难度: 简单查看答案及解析
-
在空气中直接蒸发下列盐的溶液:①Fe2(SO4)3 ②Na2CO3 ③KCl ④CuCl2 ⑤NaHCO3,可以得到相应盐的晶体(可以含有结晶水)的是
A. ①③⑤ B. ①②③ C. ②④ D. ①③④⑤
难度: 简单查看答案及解析
-
常温时,将CH3COOH溶液和NaOH溶液等体积混合后,溶液呈中性。则下列各项正确的是 ( )。
A. 混合前:pH(CH3COOH)+pH(NaOH)=14
B. 混合后:c(Na+)=c(CH3COO-)+c(OH-)
C. 混合前:c(CH3COOH)>c(NaOH)
D. 混合后:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
一定条件下,CH3COONa溶液中存在水解平衡:CH3COO-+H2O
CH3COOH+OH-,下列说法正确的是
A. 加入少量NaOH固体,c(CH3COO-)减小
B. 加入少量FeCl3固体,c(CH3COO-)减小
C. 稀释溶液,溶液的pH增大
D. 加入适量醋酸得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
难度: 简单查看答案及解析
-
已知25 ℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10,现向1 L 0.2 mol·L-1HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是
A. 25 ℃时,0.1 mol·L-1 HF溶液中pH=1
B. Ksp(CaF2)随温度和浓度的变化而变化
C. 该体系中没有沉淀产生
D. 该体系中HF与CaCl2反应产生沉淀
难度: 简单查看答案及解析
-
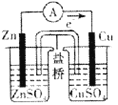
关于如图所示装置的叙述,正确的是
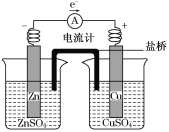
A. 铜是阳极,铜片上有气泡产生
B. 铜片质量逐渐减少
C. 电流从锌片经导线流向铜片
D. 铜离子在铜片表面被还原
难度: 中等查看答案及解析
-
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
A.充电过程中镉元素被氧化
B.充电时阳极反应:Ni(OH)2-e—+ OH—=== NiOOH + H2O
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH—向正极移动
难度: 简单查看答案及解析
-
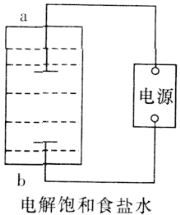
如图为用直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液。下列实验现象中正确的是
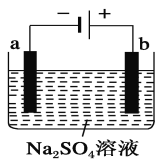
A. 逸出气体的体积,a电极的小于b电极的
B. 一电极逸出无味气体,另一电极逸出刺激性气味气体
C. a电极附近呈红色,b电极附近呈蓝色
D. a电极附近呈蓝色,b电极附近呈红色
难度: 中等查看答案及解析
-
(题文)在恒温恒容的密闭容器中通入一定量的A、B,发生反应A(g)+2B(g)
3C(g)。如图是A的反应速率v(A)随时间变化的示意图。下列说法正确的是

A. 反应物A的浓度:a点小于b点
B. 该反应的生成物可能对反应起催化作用
C. 曲线上的c、d两点都表示达到平衡状态
D. A的平均反应速率:ab段大于bc段
难度: 简单查看答案及解析
-
现有室温下四种溶液,有关叙述不正确的是
编号
①
②
③
④
pH
10
10
4
4
溶液
氨水
氢氧化钠溶液
醋酸溶液
盐酸
A. 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
C. ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D. VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11
难度: 中等查看答案及解析
-
RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,下列有关说法正确的是

A. 图1把化学能转化为电能,图2把电能转化为化学能,水得到了循环使用
B. 当有0.1mol电子转移时,a极产生0.56L O2(标准状况下)
C. c极上发生的电极反应是:O2+4H++4e-=2H2O
D. 图2中电子从c极流向d极,提供电能
难度: 困难查看答案及解析
-
一定温度下,在三个体积均为2.0L的恒容密闭容器中发生如下反应:PCl5(g)═PCl3(g)+Cl2(g)
编号
温度(℃)
起始物质的量
(mol)平衡物质的量
(mol)达到平衡所需时间
(s)PCl5(g)
PCl3(g)
Cl2(g)
Ⅰ
320
0.40
0.10
0.10
t1
Ⅱ
320
0.80
t2
Ⅲ
410
0.40
0.15
0.15
t3
下列说法正确的是
A. 平衡常数K:容器Ⅱ>容器Ⅲ
B. 反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C. 反应到达平衡时,容器I中的平均速率为v(PCl5)=0.1/t1mol/(L•s)
D. 起始时向容器Ⅲ中充入PCl50.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行
难度: 中等查看答案及解析
-
室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A. 向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B. 向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C. 0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D. 0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
难度: 中等查看答案及解析
-
以惰性电极电解CuSO4和NaCl的混合溶液,两电极上产生的气体(标准状况下测定)体积如下图所示,下列有关说法正确的是

A.a表示阴极上产生的气体,t1前产生的为Cl2
B.原溶液中CuSO4和NaCl物质的量之比为1:1
C.若t2时溶液的体积为1 L,此时溶液的pH为13
D.若原溶液体积为1 L,则原溶液中SO42的物质的量浓度为0.2 mol/L
难度: 困难查看答案及解析
-
还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
CrO42-
Cr2O72-
Cr3+
Cr(OH)3↓
已知转换过程中的反应为:2CrO42-(aq)+2H+(aq)
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol·L-1,应调溶液的pH=5
难度: 中等查看答案及解析

 3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式为________。用该电池电解100mL 1mol·L-1的AgNO3溶液,当电路中通过0.01mol电子时,被电解溶液的pH为________(溶液体积变化忽略不计)。
3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式为________。用该电池电解100mL 1mol·L-1的AgNO3溶液,当电路中通过0.01mol电子时,被电解溶液的pH为________(溶液体积变化忽略不计)。