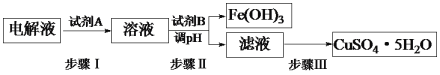-
某兴趣小组模拟氯碱工业生产原理并探究其产品的性质。已知文献记载:
①氯气与冷的氢氧化钠溶液反应生成NaClO;氯气与热的氢氧化钠溶液反应可生成NaClO和NaClO3。②在酸性较弱时KI只能被NaClO氧化,在酸性较强时亦能被NaClO3氧化。
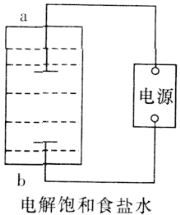
(1)该小组利用如图所示装置制取家用消毒液(主要成分为NaClO),则a为_______(填“阳极”或“阴极”)。生成NaClO的离子方程式为________。
(2)该小组将0.784L(标准状况)Cl2通入50.00mL热的NaOH溶液中,两者恰好完全反应后,稀释到250.0mL。
Ⅰ.取稀释后的溶液25.00mL用醋酸酸化,加入过量KI溶液。用0.2000mol·L-1 Na2S2O3溶液滴定:I2+2S2O32-=2I-+S4O62-,消耗Na2S2O3溶液10.00mL时恰好到达终点。
Ⅱ.将上述滴定后的溶液用盐酸酸化至强酸性,再用上述Na2S2O3溶液滴定到终点,需Na2S2O3溶液30.00mL。
①操作Ⅱ中氯酸钠与碘化钾反应的离子方程式为________。
②反应后的溶液中次氯酸钠和氯酸钠的物质的量之比为________。
-
氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O HCl+HClO K=4.5×10-4。次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代。请回答:
HCl+HClO K=4.5×10-4。次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为__________________________。
(2)84消毒液(主要成分为NaClO)与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为________________________。
(3)二氧化氯是一种高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为____________________。
(4)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧化性强弱的微型装置(如图)。

①下列溶液能吸收Cl2的是________(填字母序号)。
A.饱和食盐水
B.饱和Na2SO3溶液
C.饱和NaOH溶液
D.浓硫酸
②能说明Cl2的氧化性强于I2的实验现象是_________________________。
-
如图所示,某化学兴趣小组设计了一个燃料电池,并探究氯碱工业原理和粗铜精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:
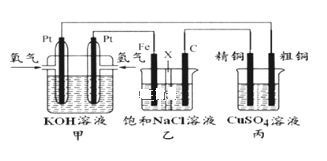
(1)通入氧气的电极为_____(填“正极”或“负极”),此电极反应式为_________。
(2)铁电极为_______(填“阳极”或“阴极”),乙装置中电解反应的化学方程式为_________________。
(3)某粗铜中含有铁、金、银和铂等杂质,通过电解精制后,为从电解液中制得硫酸铜晶体(CuSO4·5H2O),设计了如下工艺流程:
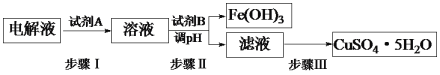
已知:几种金属阳离子开始沉淀和沉淀完全的pH。
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.7 | 6.7 |
①步骤I中加入试剂A的目的是_____________________________,试剂A应选择______(填序号);
a.氯气 b.过氧化氢 C.酸性高锰酸钾溶液
②步骤II中试剂B为_________(答出一种即可),调节pH的范围是___________;
③步骤III的操作是加热浓缩、___________、过滤。
-
(10分)利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下:
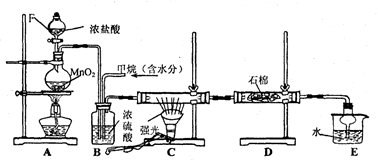
根据要求填空:
(1)装置A中反应的化学方程式为 ,当产生336mL气体(标准状况)时,有 mol还原剂被氧化。
(2)B装置有三种功能:①控制气流速度;②_______;③________________。
(3)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x的取值范围是______。
(4)D装置中的石棉上均匀附着KI粉末,其作用是_______________________。
(5)E装置的作用是____________(填编号)。
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(6)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式_______________________________。
(7)装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为_______。该装置还有缺陷,原因是没有进行尾气处理,其尾气的主要成分是__________(填编号)。
A.CH4
B.CH3Cl
C.CH2Cl2
D.CHCl3
E.CCl4
-
以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(1)电解饱和食盐水的化学方程式为________。
(2)常温下,某化学兴趣小组在实验室中,用石墨电极以右图装置进行电解某浓度氯化钠溶液的实验,电解一段时间后,收集到标准状况下氢气2.24 L。(设电解前后溶液的体积均为1 L,不考虑水的消耗或气体的溶解)

①理论上,电解后溶液中c(OH—)=________mol/L。
②若实际测得反应后溶液的c(OH—)=0.1mol/L,则造成这种误差的原因可能是:
a.2H2O 2H2↑+O2↑;若仅考虑该原因,则电解过程中溶液减小的质量是________g。
2H2↑+O2↑;若仅考虑该原因,则电解过程中溶液减小的质量是________g。
b.还可能为________(用离子方程式表示)。
经测定,该实验中溶液实际减少的质量为4.23 g,则所产生的气体及其物质的量之比为________。
-
利用甲烷与氯气发生取代反应,同时获得副产品盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下:
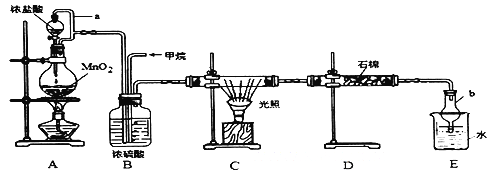
根据要求填空:
(1)A装置发生反应的离子方程式是_________________________________。C装置中CH4与Cl2生成一氯代物的化学反应方程式是___________________________ 。
(2)导管a的作用是____________。仪器b的名称是____________。
(3)D装置中的石棉上均匀附着潮湿的KI,其作用是______________ 。
(4)E装置中除了有盐酸生成外,还含有有机物。从E中分离出盐酸的最佳方法为__________E装置的作用是____________。(填序号)。
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(5)该装置的缺陷是没有进行尾气处理,其尾气的主要成分是_______.
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 E.CCl4
(6)在一定条件下甲烷也可用于燃料电池。下图是甲烷燃料电池的原理示意图:
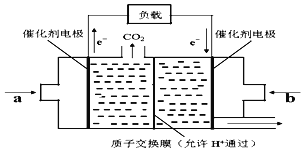
若正极的反应式为O2+4e-+4H+=2H2O,则负极反应式为___________________;
-
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程。其设计的模拟装置如下:
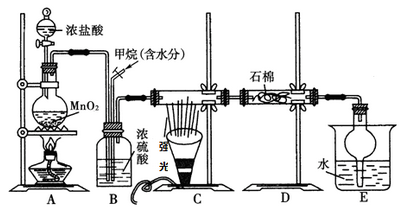
根据要求填空:
(1)B装置有三种功能:①均匀混合气体;② ;③ 。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应 。
(3)D装置的石棉中均匀混有KI粉末,其作用是 。
(4)E装置的作用是 (填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(5)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 (填分离方法名称)。
(6)该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为 (填编号)。
A.CH4B.CH3C1 C.CH2C12D.CHCl3E.CCl4
-
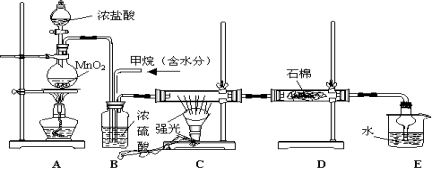
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下
根据要求填空:
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应
(3)D装置的石棉中均匀混有KI粉末,其作用是 。
(4)E装置的作用是 (填编号)
A、吸收甲烷 B、吸收氯气 C、防止倒吸 D、吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 。
(6)E装置除了生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 。该装置还有缺陷,你认为是_______________________________________________。
-
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱,以及生产ClO2 和氯的含氧酸盐(NaClO、NaClO3)等系列化工产品。
(1)写出氯碱工业中电解饱和食盐水的离子方程式:________________;某学习小组为了测定电解后所得溶液NaOH的浓度,设计了如下实验操作步骤:
①取电解后的溶液10.00mL,加水稀释至100mL;
②量取20.00mL于洁净的锥形瓶,滴加2~3滴酚酞试剂;
③用浓度为0.1010mo/L的标准HCl滴定至终点并记录滴定管的读数为25.00mL
请回答有关问题
①步骤①可能用到的仪器除移液管外,还有_______________
②滴定终点的现象是____________,此溶液中c(Na+)______c(Cl-)(填“<”、“>”或“=”)
③下列操作可能导致所得浓度偏大的是______________
a. 锥形瓶用待测溶液润洗 b.碱式滴定管用待测液润洗
c. 滴定管滴定前有气泡,滴定后无气泡 d. 滴定终点俯视读数
④该实验设计存在的明显不足的是____________
(2)已知:H2SO3的Ka1=1.54×10–2,Ka2=1.02×10–7;HClO的Ka=2.95×10–8
①室温下,0.1 mol·L–1 NaClO溶液的pH_____ 0.1 mol·L–1 Na2SO3溶液的pH。(填“大于”、“小于”或“等于”)
②写出一种可以证明NaHSO3溶液中HSO3–的电离程度大于HSO3–水解程度的方法:_____
(3)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
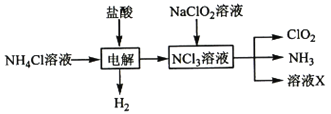
电解时发生反应的化学方程式为_______________________,溶液X的溶质主要是__________
-
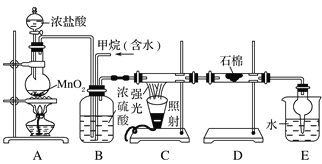
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:
根据设计要求回答:
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应________。
(3)D装置的石棉中均匀混有KI粉末,其作用是________________________________________。
(4)E装置的作用是____________(填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式____________________________________。
(6)E装置除生成盐酸外,还含有有机物,从E中分离出有机物的最佳方法为________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为______(填编号)。
a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4