-
碳循环(如图)对人类生存、发展有着重要的意义。下列说法错误的是( )
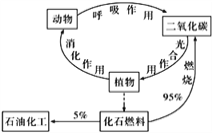
A. 碳是构成有机物的主要元素
B. 光合作用是将太阳能转化为化学能的过程
C. 化石燃料的大量燃烧是产生温室效应的原因之一
D. 石油的年产量是一个国家石油化工发展水平的标志
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列判断正确的是
A. lmolNa202与水完全反应,转移电子数为NA
B. 2molS02与1molO2在一定条件下充分反应生成S03分子数为2NA
C. 10mLpH=ll的KOH溶液中,水电离出的OH-的数H为1.0×10—5NA
D. 17g甲基(-l4CH3)中所含中子数为9NA
难度: 中等查看答案及解析
-
动植物体内广泛存在萜类化合物。关子下列萜类化合物的说法正确的是
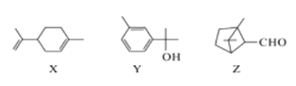
A. X、Y均属于芳香化合物
B. Z分子中所有碳原子共平面
C. X能使溴的四氯化碳溶液褪色
D. Y的一氯代物有5种
难度: 中等查看答案及解析
-
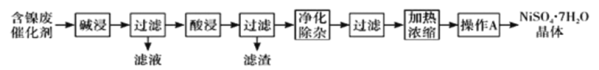
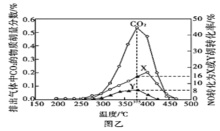
氯化铝(AlN)是一种新型无机非金属原料,常温下AlN+Na0H+H20=NaAl02+NH3↑。某课题小组利用甲图所示装置测定样品AlN的含量 (杂质不反应)。下列说法中正确的是
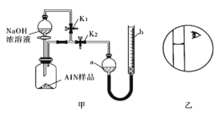
A. 量气管中的液体应为水
B. 用长颈漏斗代替分液漏斗,有利子控制反应速率
C. 反应结束时a、b两管液面的差值即为产生气体的体枳
D. 若其它操作均正确,实验结束时按乙图读数,测得AlN含量偏高
难度: 中等查看答案及解析
-
已知X、Y、Z、W、M 均为短周期元素。25℃时,其最高价氧化物对应的水化物(浓度均为0.01mol/L)溶液的pH和原子半径的关系如图所示。下列说法不正确的是
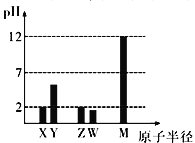
A. X、M 简单离子半径大小顺序:X>M
B. X、Y、Z、W、M 五种元素中只有一种是金属元素
C. Z 的最高价氧化物的化学式为ZO3
D. X、Z的最简单气态氢化物反应有白烟生成
难度: 中等查看答案及解析
-
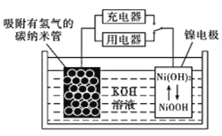
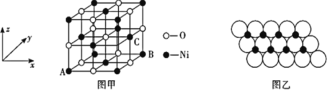
某镍冶炼车间排放的漂洗废水中含有一定浓度的Ni2+和Cl-,图甲是双膜三室电沉积法回收废水中的Ni2+的示意图,图乙描述的是实验中阴极液pH值与镍回收率之间的关系。下列说法不正确的是( )
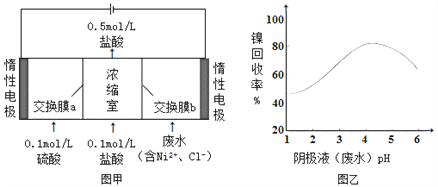
A. 交换膜a为阳离子交换膜
B. 阳极反应式为2H2O-4e-=O2+4H+
C. 阴极液 pH=1时,镍的回收率低主要是有较多的H2生成
D. 浓缩室得到1 L 0.5mol/L的盐酸时,阴极回收得到11.8g镍
难度: 中等查看答案及解析
-
电解质溶液导电能力越强,电导率越大,常温下用0.1000mol/L盐酸分别滴定10.00nL浓度均为0.1000 mol/L的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水屮电离与氯相似,己知在常温下KP[(CH3)2NH H2O]NH•H2O],利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 盐酸滴定二甲胺实验中选择酚酞做指示剂比选甲基橙误差更小
B. d点溶液中:c(H+)<c(OH-)(CH3)2NH2+
C. a点洛液与d点的洛液混合后的洛液中:c[(CH3)2NH2+]<c((CH3)2NH•H2O]
D. b、c、e三点的溶液中,水的电离程度最大的是e点
难度: 中等查看答案及解析