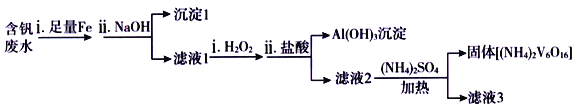
-
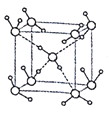
化学与生产、生活密切相关,下列有关说法正确的是
A. 由地沟油加工合成的“生物柴油”与柴油成分相同
B. 煤的液化是将煤处理成清洁能源的一种物理方法,可减少PM2.5引起的危害
C. 海水提镁、炼铁、制造玻璃等工业都用到石灰石
D. 食盐中加碘单质可以减少碘缺乏症
难度: 中等查看答案及解析
-
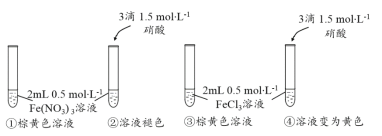
对下列实验现象解释正确的是
实验内容
实验现象
相关解释
A
等量的Cu分别与等体积足量的浓硝酸和稀硝酸反应
浓硝酸反应后呈绿色,稀硝酸反应后呈蓝色
c(Cu2+)不同
B
NH3与Cl2混合
生成白烟
NH3与Cl2发生化合反应生成NH4Cl
C
往Fe(OH)3胶体中逐滴滴入稀盐酸
先出现红褐色沉淀,后沉淀溶解
先胶体聚沉,后Fe(OH)3溶解
D
加热硝酸铜固体,将带火星的木条伸入所得的气体中
生成红棕色气体,带火星木条复燃
2Cu(NO3)2
2CuO+4NO2↑+O2↑有氧气生成,不能说明NO2有助燃性。
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知电极上每通过96500 C的电量就会有1 mol电子发生转移。精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量。实际测量中,常用银电量计,如图所示。下列说法不正确的是
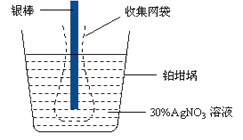
A. 若要测定电解饱和食盐水时通过的电量,可将该银电量计中的银棒与待测电解池的阳极相连,铂坩埚与电源的负极相连。
B. 称量电解前后铂坩埚的质量变化,得金属银的沉积量为108.0 mg,则电解过程中通过电解池的电量为96.5 C
C. 实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋。若没有收集网袋,测量结果会偏高。
D. 电量计中的银棒应与电源的正极相连,铂坩埚上生的电极反应是:Ag+ + e- = Ag
难度: 中等查看答案及解析
-
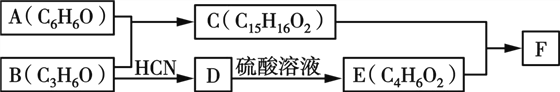
短周期主族元素W、X、Y、Z 的原子序数依次增大:W、X、Y、Z组成的单质可发生如图所示的化学反应;B是生活中最常见的液体;常温下Y、Z 组成的二元化合物的水溶液pH=7。下列说法错误的是
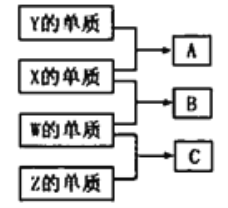
A. A 与B 的反应一定是化合反应
B. 离子半径: Z>X>Y>W
C. W、Y、Z 均存在两种或两种以上的氧化物
D. 将等物质的量的A、C溶于同一烧杯水中,所得溶液的pH一定大于7
难度: 中等查看答案及解析
-
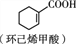
连二苯(
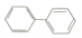 )苯环上的两个氢原子分别被-C2H3Br2和—CH3取代,形成的同分异构体有(不考虑立体异构)
)苯环上的两个氢原子分别被-C2H3Br2和—CH3取代,形成的同分异构体有(不考虑立体异构)A. 12种 B. 36种 C. 38种 D. 57种
难度: 困难查看答案及解析
-
一定条件下将质量m g的有机物在氧气中完全燃烧,燃烧后全部产物缓慢通过足量过氧化钠,充分反
应后过氧化钠固体增重n g,关于下列情况说法正确的是
有机物
n
A
CH4
2m
B
HCHO
3m/2
C
CH3OH和CH3COOH的混合物
2m/3
D
C2H5OH和CH3COOC2H5的混合物
m
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
已知:pOH= -lgc(OH-)。298 K时,向20.00 mL0.10mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH和pOH与加入盐酸体积关系如图所示。下列说法正确的是
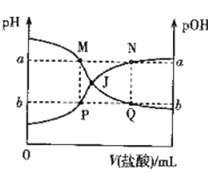
A. 曲线PJN表示溶液中PH的变化
B. M点水的电离程度比Q点大
C. M、P两点的数值之和a + b = 14
D. pH与pOH交叉点J对应的V(盐酸)=20.00 mL
难度: 中等查看答案及解析