-
德国著名行业杂志《应用化学》上刊登文章介绍:某中德联合研究小组设计制造了一种“水瓶”,用富勒烯(C60)的球形笼子作“瓶体”,一种磷酸盐作“瓶盖”,恰好可将一个水分子关在里面。下列说法正确的是
A.水、王水、双氧水都是纯净物
B.石墨和C60互为同位素
C.磷酸钙中所含元素都是短周期元素
D.一定条件下石墨转化为C60是化学变化
难度: 中等查看答案及解析
-
关于化学反应A+B→C+D,下列说法中正确的是
A.若生成物C和D分别是盐和水,则反应物一定是酸和碱
B.若A和C是单质,B和D是化合物,则该反应一定是置换反应
C.若A是可溶性碱,B是可溶性盐,则C和D一定是两种沉淀
D.若A、B各取10 g混合,使其充分反应,则C、D质量的总和一定等于20 g
难度: 中等查看答案及解析
-
在杠杆的两端分别挂着质量和体积都相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在氢氧化钠溶液和硫酸铜溶液中片刻(如下图所示),则下列说法正确的是
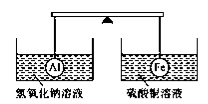
A.两烧杯中均无气泡产生 B.左边烧杯中的溶液质量减少了
C.去掉两烧杯,杠杆仍平衡 D.右边铁球上出现红色
难度: 简单查看答案及解析
-
下列各项中,表达正确的是
A.甲醛的结构简式:HCOH B.C2H2分子的结构式:CH≡CH
C.CH4分子的比例模型:
D.异丁烷的键线式:
难度: 简单查看答案及解析
-
为了检验某固体物质中是否含有NH4+,下列试纸和试剂一定用不到的是
①蒸馏水 ②NaOH溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀硫酸
A.①⑤ B.④⑤ C.①③ D.①④⑤
难度: 中等查看答案及解析
-
分类法是学习化学的重要方法,人们在认识事物时可采用多种分类方法。下列(2)中的物质不能与(1)中的物质归为一类的是
选项
(1)
(2)
A
FeSO4、NO2、MnO2、NaClO、Cu3P、Na2O2
H2SO3
B
CH3COOH、HOOC—COOH、HClO、H2S
HF
C
复分解反应、电解反应、放热反应、离子反应
焰色反应
D
(NH4)2SO4、NH4Cl、NH4NO3、NH3·H2O
NH4HCO3
难度: 简单查看答案及解析
-
青石棉(crocidolite)是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为Na2Fe5Si8O22(OH)2。青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法不正确的是
A.青石棉是一种硅酸盐产品
B.青石棉中含有一定量的石英晶体
C.青石棉的化学组成可表示为Na2O·3FeO·Fe2O3·8SiO2·H2O
D.1 mol青石棉能使1 mol HNO3被还原
难度: 中等查看答案及解析
-
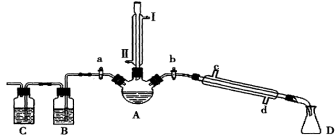
下列有关实验装置进行的相应实验,能达到实验目的的是

A.用图1装置可以验证溴乙烷发生了消去反应
B.用图2装置配制银氨溶液
C.用图3装置提纯工业乙醇
D.用图4装置萃取溴水中的溴,并把溴的苯溶液从下口放出
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的数值,下列叙述正确的是
A.常温常压下,2.8 g N2与C2H4的混合气体中含有的电子数为1.4NA
B.标准状况下,1.12 L NO与1.12 L O2的混合物中含有的原子数为0.2NA
C.25 ℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA
D.常温下,1 L 0.1 mol·L-1的NH4NO3溶液中氧原子数为0.3NA
难度: 困难查看答案及解析
-
下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是
A.NH4Cl→NH3↑+HCl↑
B.NH3+CO2+H2O→NH4HCO3
C.2NaOH+Cl2→NaCl+NaClO+H2O
D.2Na2O2+2CO2→2Na2CO3+O2
难度: 中等查看答案及解析
-
某含有铝电极的原电池工作时,电子从铝电极上流出,下列有关该电池另一种电极的材料与电解质溶液的说明中肯定错误的是
A.镁、NaOH溶液 B.铜、稀硫酸
C.锌、浓硝酸 D.铁、FeCl3
难度: 中等查看答案及解析
-
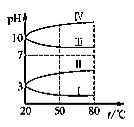
某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是
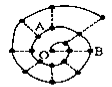
A.离O点越远的元素原子半径越大 B.虚线相连的元素处于同一族
C.B元素是图中金属性最强的元素 D.A、B组成的化合物中可能含有共价键
难度: 中等查看答案及解析
-
将某固体氢氧化物M与NH4Cl置于如图所示的装置(玻璃片与烧杯底部之间有一薄层水)中混合反应后,用手拿起烧杯时,发现玻璃片与烧杯粘在一起,则该反应所对应的能量变化关系图是

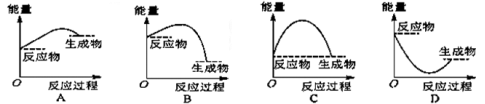
难度: 中等查看答案及解析
-
为了探索外界条件对反应aX(g)+bY(g)
cZ(g)+Q的影响,以X和Y物质的量比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。以下判断正确的是
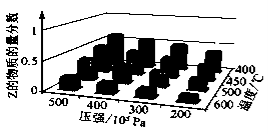
A.Q<0,a+b>c B.Q<0,a+b<c
C.Q>0,a+b>c D.Q>0,a+b<c
难度: 中等查看答案及解析
-
天然油脂结构的核心为甘油[HOCH2CH(OH)CH2OH],有一瘦身用的非天然油脂,其结构的核心则为蔗糖(C12H22O11)。该非天然油脂可由直链型的不饱和油酸(C17H33COOH)与蔗糖反应而得,其反应示意图如下图所示(注意图中的反应式不完整)。
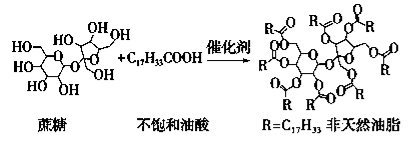
下列说法正确的是
A.蔗糖酯也是高级脂肪酸的甘油酯,属于油脂类物质
B.该非天然油脂与氢氧化钠溶液共热,其水解产物不与溴水反应
C.非天然油脂为高分子化合物
D.该蔗糖酯在稀硫酸的作用下水解,最终可生成多种有机分子
难度: 困难查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
实验操作
现象
解释或结论
A
向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液
出现白色沉淀
溶液X中一定含有SO42-
B
等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体
HA放出的氢气多且反应速率快
HB酸性比HA强
C
在镁、铝为电极,氢氧化钠为电解质的原电池装置中
镁表面有气泡
金属活动性:Al>Mg
D
向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后加入0.5 mL有机物Y加热
未出现砖红色沉淀
Y中不含有醛基
难度: 困难查看答案及解析
-
铅的冶炼大致过程如下:①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2
2PbO+2SO2;③制粗铅:PbO+C
Pb+CO↑;PbO+CO
Pb+CO2。下列说法正确的是
A.浮选法富集方铅矿的过程属于化学变化
B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
C.整个冶炼过程中,制取1 mol Pb共转移2 mol电子
D.将1 mol PbS完全冶炼成Pb理论上至少需要6 g碳
难度: 中等查看答案及解析
-
常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如下图所示。下列说法中,正确的是
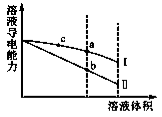
A.两溶液稀释前的浓度相同
B.a、b、c三点溶液的pH由大到小顺序为a>b>c
C.a点的KW值比b点的KW值大
D.a点水电离的c(H+)大于c点水电离的c(H+)
难度: 困难查看答案及解析
-
对表中有关离子方程式书写、评价合理的是
选项
化学反应及其离子方程式
评价
A
Fe3O4与过量稀硝酸反应:Fe3O4+8H+→2Fe3++Fe2++4H2O
正确
B
在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液:
2Fe3++ 3SO42-+ 3Ba2++6OH-→3BaSO4↓+ 2Fe(OH)3↓
正确
C
在稀氨水中通入过量CO2:NH3·H2O+CO2→NH4++HCO3-
正确
D
FeBr2溶液与等物质的量的Cl2反应:
2Fe2++2Br—+2Cl2→2Fe3++4Cl—+Br2
错误,Fe2+与Br—的化学计量数之比应为1:2
难度: 中等查看答案及解析
-
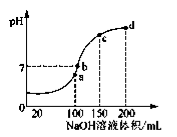
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是
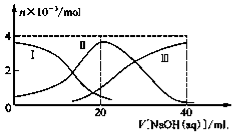
A.当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系:
c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C.H2A第一步电离的方程式为H2A→HA- +H+
D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减少
难度: 困难查看答案及解析
-
向等量的NaOH溶液中分别通入CO2气体。因CO2的通入量不同,得到组分不同的溶液M。若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)关系如下,(注:①假设CO2全部逸出;②C图中oa=ab)。其中M中只有1种溶质的是
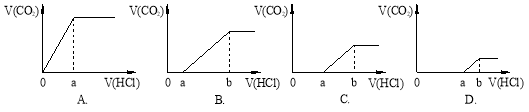
难度: 中等查看答案及解析
-
向一定量的Fe,FeO,Fe2O3,Fe3O4的混合物中,加入150mL 4mol/L的稀硝酸,恰好使混合物完全溶解,并放出标准状况下NO气体2.24L,往所得溶液中加KSCN溶液,无红色出现。若用一定量的氢气在加热条件下还原相同质量的该混合物,所得固体的物质的量可能为
A.0.30 mol B.028mol C.0.25mol D.0.22 mol
难度: 困难查看答案及解析