-
已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
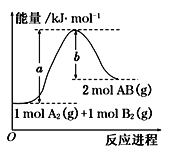
A. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
B. 每生成2 mol AB(g)吸收b kJ能量
C. 该反应中反应物的总能量高于生成物的总能量
D. 该反应热ΔH=(a-b) kJ·mol-1
难度: 简单查看答案及解析
-
工业上由CO2和H2合成气态甲醇的热化学方程式为CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-50 kJ·mol-1。下面表示合成甲醇的反应的能量变化示意图,其中正确的是( )
A.
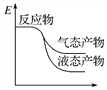 B.
B. 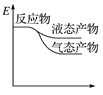 C.
C. 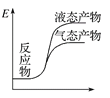 D.
D. 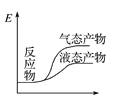
难度: 中等查看答案及解析
-
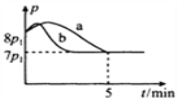
已知:4NH3 (g)+5O2 (g)
4NO (g)+6H2O (g) ΔH=-1 025kJ/mol,该反应是一个可逆反应,若反应起始物质的量相同,下列关于该反应的示意图不正确的是( )
A.
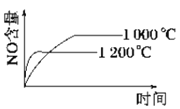 B.
B. 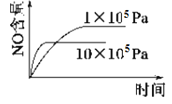 C.
C. 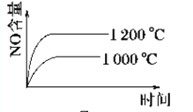 D.
D. 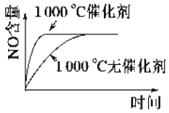
难度: 简单查看答案及解析
-
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法正确的是( )。
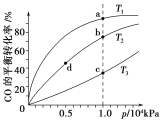
A. 温度:T1>T2>T3
B. 正反应速率:v(b)>v(d) v(a)>v(c)
C. 平衡常数:K(a)>K(c) K(b)=K(d)
D. 平均摩尔质量:M(b)>M(d) M(a)<M(c)
难度: 困难查看答案及解析
-
一定量的气体在密闭容器中发生反应:xA(g) + yB(g)
zC(g),平衡时测得A的浓度为1.0mol/L,保持温度不变,将容器的容积扩大到原来的2倍,达新平衡后, 测得A的浓度降低为0.60 mol/L。下列有关判断正确的是
A. 平衡向正反应方向移动
B. 物质B的转化率降低
C. x + y < z
D. 物质C的体积分数增大
难度: 困难查看答案及解析
-
根据如下能量关系示意图,下列说法正确的是
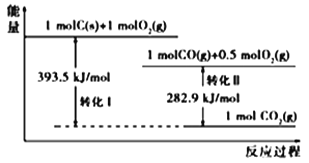
A. 1 molC(g)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g) ===2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C→CO的热化学方程式为:2C(s)+O2(g) ===2CO(g) ΔH= −221.2 kJ∙mol−1
D. CO的燃烧热ΔH=+282.9 kJ∙mol−1
难度: 中等查看答案及解析
-
由下表提供数据及相关物质结构知识,反应1:SiCl4(g)+2H2(g)=Si(g)+4HCl(g),反应2:Si(g)+O2(g)=SiO2(g),则反应1和反应2的反应热为
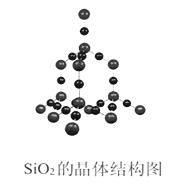 硅的晶体结构
硅的晶体结构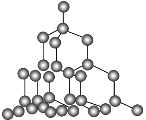
化学键
Si-Cl
H-H
Si-Si
H-Cl
O=O
Si-O
键能kJ/mol)
360
436
176
431
498
460
A. +236kJ/mol,-990kJ/mol B. -116kJ/mol,-990kJ/mol
C. -116kJ/mol,-70kJ/mol D. +236kJ/mol,-70kJ/mol
难度: 中等查看答案及解析
-
下列热化学方程式正确的是
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)
2NH3(g)ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2x(-57.3)kJ·mol-1
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH=a kJ·mol-1,2C(s)+O2(g)=2CO(g) ΔH=b kJ·mol-1,则a<b
难度: 困难查看答案及解析
-
在一定条件下有反应: 2SO2(g)+O2(g)
2SO3(g) △H=-197kJ/mol.现有容积相同的甲、乙、丙三个定容容器。在上述条件下分别充入的气体和反应放出的热量(Q) 如表所示:
容器
SO2(mol)
O2(mol)
N2(mol)
Q(kJ)
甲
2
1
0
Q1
乙
1
0.5
0
Q2
丙
1
0.5
1
Q3
根据以上数据,下列叙述不正确的是:
A. Q1<197
B. 在上述条件下,反应生成1molS03气体放热98.5kJ
C. Q2=Q3
D. Q3<Q1<2Q2
难度: 困难查看答案及解析
-
意大利罗马大学的Fulvio Cacace等人获得极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,断裂1molN≡N吸收942kJ热量.根据以上信息和数据,下列说法正确的是( )
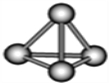
A. N4属于一种新型的化合物,与N2互为同素异形体
B. N4的沸点比白磷(P4)的高
C. 1mol N4转化为2mol N2的同时放出能量
D. 相同质量的N4和 N2所含原子个数比为1:2
难度: 困难查看答案及解析
-
反应:L(s)+aG(g)
bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。
据此可判断( )
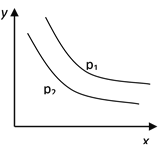
A. 上述反应是放热反应
B. 上述反应是吸热反应
C. a>b
D. 增大压强,平衡向正反应方向移动
难度: 困难查看答案及解析
-
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)
NH3(g)+HI(g);②2HI(g)
H2(g)+I2(g)达到平衡时,c(H2)=1 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
A. 36 B. 24 C. 16 D. 9
难度: 中等查看答案及解析
-
已知反应:2NO2(红棕色)
N2O4(无色),分别进行如下两个实验:
实验ⅰ:将NO2球分别浸泡在热水和冰水中,现象如图1。
实验ⅱ:将一定量的NO2充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(气体颜色越深,透光率越小),如图2。下列说法不正确的是
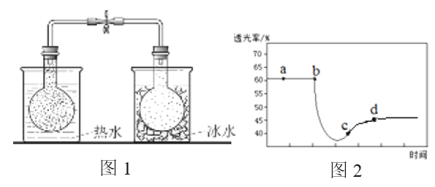
A. 图1现象说明该反应为放热反应
B. 图2中b点的操作是压缩注射器
C. c点:v(正)>v(逆)
D. 若没有能量损失,考查体系温度变化,则T(d)<T(c)
难度: 中等查看答案及解析
-
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)
3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
A. 2.5mol C B. 2 mol A、2 mol B和10 mol He(不参加反应)
C. 1.5 mol B和1.5 mol C D. 2 mol A、3 mol B和3 mol C
难度: 中等查看答案及解析
-
Bodensteins研究了下列反应:2HI(g)
H2(g)+I2(g)
。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min
0
20
40
60
80
120
x(HI)
1
0.91
0.85
0.815
0.795
0.784
x(HI)
0
0.60
0.73
0.773
0.780
0.784
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当升高温度,再次达到平衡时,v正 v逆可能落在A、B、C、D、E哪些点。
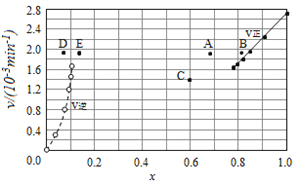
A. A D B. B D C. B E D. A E
难度: 中等查看答案及解析
-
可逆反应①X(g)+2Y(g)
2Z(g)、②2M(g)
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦力、可自由滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
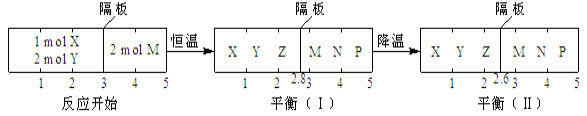
下列判断正确的是( )
A. 反应①的正反应是吸热反应
B. 达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C. 达平衡(I)时,X的转化率为5/11
D. 在平衡(I)和平衡(II)中,M在隔板右边气体中的体积分数不变
难度: 困难查看答案及解析