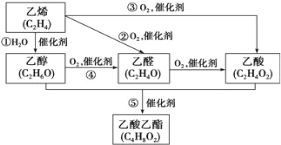
-
把含有氧化铁的铁片投入到足量的稀硫酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且生成的Fe2+与反应生成的H2的物质的量之比为3︰1,则原混合物中Fe2O3与Fe的物质的量之比为( )
A. 1︰1 B. 2︰5 C. 4︰1 D. 3︰1
难度: 中等查看答案及解析
-
配制100 mL 0.1 mol·L-1Na2CO3溶液,下列操作正确的是( )
A. 称取1.06 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B. 称取1.06 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C. 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D. 定容后,塞好瓶塞,反复倒转,摇匀
难度: 中等查看答案及解析
-
能证明硅酸的酸性弱于碳酸酸性的实验事实是( )
A. CO2溶于水形成碳酸,SiO2难溶于水
B. CO2通入可溶性硅酸盐中析出硅酸沉淀
C. 高温下SiO2与碳酸盐反应生成CO2
D. HCl通入可溶性碳酸盐溶液中放出气体,氯化氢通入可溶性硅酸盐溶液中生成沉淀
难度: 中等查看答案及解析
-
短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅡA族,W 与X属于同一主族。下列说法正确的是( )
A. 离子半径:r(W) > r(Z) > r(Y)
B. X、W 的简单氢化物的沸点:X>W
C. Y 的最高价氧化物对应水化物的碱性比Z的弱
D. 由X、Y 组成的化合物一定含离子键和共价键
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数,下列说法正确的是( )
A. 5.6 g铁与足量盐酸反应转移的电子数为0.3NA
B. 常温常压下,11.2L甲烷中含有的氢原子数为2NA
C. 标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA
D. 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
难度: 中等查看答案及解析
-
取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,标准状况下均产生5.6 L气体,则两份铝片的质量之比为
A. 一定为1∶1 B. 可能为2∶3 C. 一定为3∶2 D. 可能为1∶6
难度: 简单查看答案及解析
-
下列化学用语表达正确的是( )
A. 氯离子的结构示意图:
B. HClO的结构式为:H﹣Cl﹣O
C. 乙酸的分子式:CH3COOH D. 氯化镁的电子式:
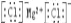
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 对于A(s)+B(g)
C(g)+D(g)的反应,加入A,反应速率加快
B. 2NO2
N2O4(正反应放热),升高温度,v(正)增大,v(逆)减小
C. 一定温度下,反应 N2(g)+3H2(g)
2NH3(g)在密闭容器中进行,恒压,充入He不改变化学反应速率
D. 100 mL2 mol·L—1稀盐酸与锌反应时,加入少量硫酸铜固体,生成氢气的速率加快
难度: 中等查看答案及解析
-
在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s)
C(g)+D(g),下列描述中不能表明反应已达到平衡状态的是( )
A. 混合气体的密度不变 B. 单位时间内生成n molD,同时生成n molC
C. 混合气体的平均相对分子质量不变 D. C(g)的物质的量浓度不变
难度: 中等查看答案及解析
-
利用反应6NO2+8NH3 =7N2+12H2O构成电池的装置如图所示。下列说法正确的是( )
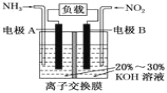
A. 电子从右侧B电极经过负载后流向左侧A电极
B. 当有2.24 L NO2被处理时,转移电子数为0.4NA
C. 电极A极反应式为2NH3-6e-= N2+6H+
D. 为使电池持续放电,离子交换膜需选用阴离子交换膜
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述正确的是( )
A. 烷烃中除甲烷外,很多都能使酸性KMn04溶液的紫色褪去
B. 15g甲基(﹣CH3)含有的电子数是9NA
C. 7.8g苯中含有的碳碳双键数为0.3NA
D. 标准状况下,2.24 L CCl4中的原子总数为0.5NA
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 1mol N2 的质量是14g B. H2SO4的摩尔质量是98 g/mol
C. H2O的摩尔质量是18 D. 1mol HCl的质量是36.5 g /mol
难度: 简单查看答案及解析
-
下列物质中既能导电,又属于强电解质的一组物质是( )
A. 醋酸溶液、食盐晶体 B. 熔融状态的KOH、熔融状态的NaCl
C. NaOH溶液、纯HNO3 D. 液氨、石灰水
难度: 中等查看答案及解析
-
在盐类水解的过程中,下列说法正确的是
A. 盐的电离平衡被破坏
B. 水的电离程度一定会增大
C. 溶液的pH一定会增大
D. c(H+)与c(OH-)的乘积一定会增大
难度: 简单查看答案及解析
-
对于等物质的量浓度的Na2CO3和NaHCO3溶液,下列说法不正确的是( )
A. 分别升高温度,两种溶液的pH均减小
B. 相同温度下两种溶液的pH:Na2CO3>NaHCO3
C. 分别加入少量NaOH,两溶液中c(CO32—)均增大
D. 两溶液均存在c(Na+)+c(H+)=c(OH-)+c(HCO3—)+2c(CO32—)
难度: 简单查看答案及解析
-
等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)
2Z(g)+W(s)ΔH<0,下列叙述正确的是( )
A. 达到平衡时,反应速率v正(X)=2v逆(Z)
B. 平衡常数K值越大,X的转化率越大
C. 达到平衡后降低温度,平衡向逆反应方向移动
D. 达到平衡后,增大压强有利于该反应平衡向逆反应方向移动
难度: 中等查看答案及解析
-
下列关于电离常数(K)的说法正确的是
A. 电离平衡常数只与温度有关,升高温度,K值减小
B. 电离常数K与温度无关
C. 电离常数(K)越小,表示弱电解质的电力能力越弱
D. 多元弱酸各步电离常数相互关系为K1<K2<K3
难度: 简单查看答案及解析
-
实验:①向盛有1 mL 0.1 mol·L-1MgCl2溶液试管中加1 mL 0.2 mol·L-1NaOH溶液,得到浊液a,过滤得到滤液b 和白色沉淀c。②向沉淀c中滴加0.1mol·L-1FeCl3溶液,沉淀变为红褐色。下列分析不正确的是( )
A. 滤液b中不含有Mg2+
B. 实验可以证明Fe(OH)3比Mg(OH)2更难溶
C. ②中颜色变化说明Mg(OH)2转化为Fe(OH)3
D. 浊液a中存在沉淀溶解平衡:Mg(OH)2(s) ⇋Mg2+ (aq)+2OH-(aq)
难度: 中等查看答案及解析
-
在醋酸溶液中,CH3COOH电离达到平衡的标志是
A. 溶液显酸性
B. 溶液中无CH3COOH分子存在
C. 氢离子浓度恒定不变
D. c(H+)= c(CH3COO-)
难度: 中等查看答案及解析
-
某同学利用右图实验装置探究盐桥式原电池的工作原理,盐桥中除添加琼脂外,还要添加KCl的饱和溶液。下列叙述正确的是( )

A. 导线中电子流向为b→a
B. 电池工作时,电流方向a→b
C. 电池工作时,盐桥中的K+向右侧烧杯移动,Cl-向左侧烧杯移动
D. 电池工作时,盐桥中的K+向左侧烧杯移动,Cl-向右侧烧杯移动
难度: 中等查看答案及解析