-
下列实验中,现象和结论都正确的是
实验
现象
结论
A.
将SO2通入BaCl2溶液,然后滴入稀硝酸
产生白色沉淀,白色沉淀不消失
所得沉淀为BaSO3,后转化为BaSO4
B.
将浓硫酸滴入含少量水的蔗糖中,并搅拌
得黑色蓬松的固体及刺激性气味气体
该过程中浓硫酸仅体现吸水性和脱水性
C.
用黄豆粒大小的金属钠分别与水、乙醇反应
前者反应更剧烈
羟基的活动性:水>乙醇
D.
向10mL0.1mol/LNaOH溶液中加入1mL0.1mol/L MgCl2溶液,再向混合液中滴加0.1mol/L CuCl2溶液
产生蓝色沉淀
Cu(OH)2比Mg(OH)2更难溶
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列溶液中有关说法正确的是
A. 室温下,0.1 mol/LNaHA溶液中离子浓度的关系有:c(Na+)=c(HA-)+c(OH-)+2c(A2-)
B. 向0.1 mol/L(NH4)2SO4溶液中滴加少量浓硫酸,不引起明显体积变化,则c(NH4+)与c(SO42-)均增大
C. 已知Ksp(CuS)=1.3×10-36,则将足量CuSO4溶解在0.1 mol/L的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35 mol/L
D. 常温下,pH=5.6的CH3COOH与CH3COONa的混合溶液中,c(Na+)>c(CH3COO-)
难度: 中等查看答案及解析
-
化学与人类社会的生产、生活有着密切联系。下列叙述中不正确的是

氧化铁
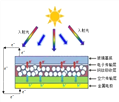
钙钛矿太阳能电池
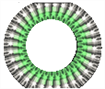
SiO2超分子纳米管

石墨烯发热服
A.用作涂料
B.化学能转化为电能
C.无机非金属材料
D.有电热转化性能
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
已知34Se、35Br位于同一周期,根据元素在周期表中的位置,下列说法正确的是
A. 还原性:Cl->Br- B. 酸性:H2SeO4>HBrO4>HClO4
C. 原子半径:Se>Br>Cl D. 气态氢化物的稳定性:H2Se>H2S
难度: 中等查看答案及解析
-
洁厕灵和84消毒液混合使用会发生反应:NaClO+2HCl=NaCl+Cl2↑+H2O,生成有毒的氯气。NA代表阿伏加德罗常数的值,下列说法正确的是
A. 每生成1mol氯气,转移的电子数为2NA
B. 1molNaCl含有的电子数为28NA
C. 1L0.2mol/LNaClO溶液中含有的次氯酸根离子数为0.2NA
D. 标准状况下,将22.4LHCl溶解在0.5L水中,形成2mol/L的盐酸
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 滴入石蕊显红色的溶液:Na+、NH4+、NO3-、Cl-
B. 0.1mol·L-1Fe(NO3)2溶液:H+、Al3+、SO42-、Cl-
C. pH=2的溶液:K+、Na+、NO3-、A1O2-
D. c(H+)/c(OH-)=1012mol·L-1的溶液:Ca2+、NH4+、Cl-、HCO3-
难度: 中等查看答案及解析
-
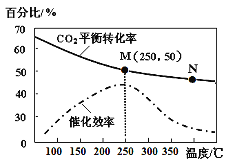
已知分解1mol H2O2放出热量98kJ。在含有少量I-的溶液中,H2O2分解机理为:
①H2O2 + I-
H2O + IO-慢
②H2O2 + IO-
H2O + O2 + I- 快
下列说法不正确的是
A. ν(H2O2) =ν(H2O) =ν(O2) B. 反应的速率与I-浓度有关
C. I-是该反应的催化剂 D. 反应①活化能大于反应②的活化能
难度: 中等查看答案及解析
-
某液态烃的球棍模型为:
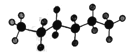 ,有机物R与该烃分子式相同,且结构中有四个甲基。下列有关R的说法中正确的是
,有机物R与该烃分子式相同,且结构中有四个甲基。下列有关R的说法中正确的是A. R能使溴的四氯化碳溶液褪色 B. R可能是2,2-二甲基丁烷
C. R不溶于水且密度比水大 D. R的一氯代物一定有2种
难度: 中等查看答案及解析
-
甲、乙、丙、丁、戊 的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不满足下图所示转化关系的是
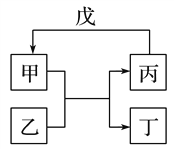
选项
甲
乙
丙
戊
A
NH3
Cl2
N2
H2
B
C
SiO2
CO
CuO
C
Al(OH)3
NaOH溶液
NaAlO2溶液
CO2
D
乙酸乙酯
NaOH溶液
乙醇
乙酸
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知NO和O2转化为NO2的反应机理如下:
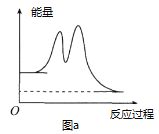
①2NO(g)
N2O2(g)(快)△H1<0,平衡常数K1
②N2O2(g)+O2(g)
2NO2(g)(慢) △H2<0,平衡常数K2
下列说法正确的是( )
A. 2NO(g)+O2(g)
2NO2(g)的△H=△H1+△H2
B. 2NO(g)+O2(g)
2NO2(g)的平衡常数K= K1/K2
C. 反应①的速率大小决定2NO(g)+O2(g)
2NO2(g)的反应速率
D. 反应过程中的能量变化可用图a表示
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y 的简单氢化物中,常温下,Z的单质能溶于W的最高价氧化物对应的水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是
A. Q氧化物对应水化物的酸性强于W氧化物对应水化物的酸性
B. 原子半径大小顺序为Q>Z>W>X>Y
C. 元素X与Y组成的化合物均能溶于水
D. 元素X的简单气态氢化物比Y的简单气态氢化物稳定性差
难度: 中等查看答案及解析
-
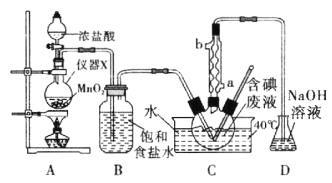
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。利用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中不正确的是

A. 阳极反应式为4OH--4e-=2H2O+O2↑
B. 从A口出来的是硫酸溶液
C. b是阳离子交换膜,允许Na+通过
D. Na2SO4溶液从E口加入
难度: 中等查看答案及解析
-
H2和I2在一定条件下能发生反应:H2(g)+I2(g)
2HI(g)△H=—a kJ/mol,下列说法正确的是( )
已知:
 (a、b、c均大于零)
(a、b、c均大于零)A. H2、I2和HI分子中的化学键都是非极性共价键
B. 断开2 mol HI分子中的化学键所需能量约为(c+b+a) kJ
C. 相同条件下,1 mol H2 (g)和1mol I2 (g)总能量小于2 mol HI (g)的总能量
D. 向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量为2a kJ
难度: 中等查看答案及解析
-
向18.4 g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成NO2、NO混合气体,再向所得溶液中加入足量的NaOH溶液,生成30.3 g沉淀。另取等质量的合金,使其与一定量的Cl2恰好完全反应,则Cl2 的体积在标准状况下为
A. 4.48L B. 6.72L C. 7.84L D. 无法计算
难度: 困难查看答案及解析