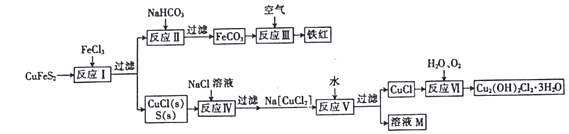
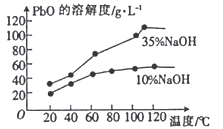
-
化学与生活、社会密切相关,下列说法正确的是
A. 柠檬虽然很酸,但在人体内代谢后会生成碱性物质,因此柠檬属于碱性食物
B. 通信光缆的主要成分是晶体Si,太阳能电池的材料主要是SiO2
C. 高锰酸钾溶液、酒精、双氧水都能杀菌消毒,都利用了强氧化性
D. 以“地沟油”为原料生产的生物柴油与以“石油”为原料生产的柴油化学成分相似
难度: 简单查看答案及解析
-
中国传统文化对人类文明贡献巨大,《本草纲目》中有如下记载:“(火药)乃焰消(KNO3)、硫黄、杉木炭所合,以为烽燧铳机诸药者”,其中利用的KNO3的性质是
A. 自燃性 B. 易分解 C. 还原性 D. 氧化性
难度: 简单查看答案及解析
-
下列有关化学现象和化学概念表述正确的是
A. 0.5molFe和含1mol HNO3的稀溶液充分反应后,滴入KSCN溶液,溶液变红
B. Fe(OH)3胶体做电泳实验时,由阴极区红色加深可知Fe(OH)3胶体带正电荷
C. 含有143个中子的U(92号)原子的原子符号:
U
D. 1mol H3PO3最多可与2 mol NaOH发生中和反应,因此Na2HPO3属于正盐
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 向NH4HSO4溶液中滴加NaOH溶液至中性:H++OH—===H2O
B. 用惰性电极电解MgBr2溶液,阴极的电极反应式为:2H2O+Mg2++2e—===H2↑+Mg(OH)2↓
C. 饱和碳酸钠溶液中通入二氧化碳气体:CO32—+CO2+H2O===2HCO3—
D. 酸性KMnO4溶液中滴加少量H2O2,紫色褪去:2MnO4—+H2O2+6H+===2Mn2++3O2↑+4H2O
难度: 中等查看答案及解析
-
常温下,下列有关离子共存的说法中正确的是( )
A. 某无色溶液中可能大量存在Al3+、NH4+、Cl—、SiO32—
B. 水电离出H+浓度为1×10-13 mol·L−1的澄淸透明溶液中可能大量存在Mg2+、Cu2+、SO42—、NO3—
C. 小苏打溶液中,可能大量存在I—、NO3—、Ba2+、ClO—
D. 使甲基橙呈红色的溶液中,可能大量存在NH4+、K+、AlO2— 、Cl—
难度: 中等查看答案及解析
-
下列叙述正确的是
A.
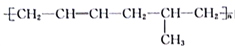 由3种单体加聚得到
由3种单体加聚得到B. 氨基酸溶于过量氢氧化钠溶液中生成的离子,在电场作用下向阴极移动
C. 甲苯与足量H2加成产物的一氯取代物有5 种
D. 分子式为C4H6O2并能与饱和NaHCO3溶液反应生成CO2的有机物有3种(不含立体异构)
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的数值,下列说法正确的是
A. 6.0g SiO2中含有0.1NA个SiO2分子
B. 标准状况下,向1L密闭容器中充入46g NO2气体,容器中的分子数为NA
C. 过氧化钠与水反应,每生成0.1mol氧气,转移电子的数目为0.4NA
D. 常温常压下,7.0g由丁烯与丙烯组成的混合物中含有氢原子的数目为NA
难度: 中等查看答案及解析
-
甲、乙、丙、丁分别为A、B、C、D四种短周期元素的最高价氧化物对应的水化物,已知0.1mol·L-1甲、丙、丁溶液的pH与A、C、D的原子序数关系如图所示(lg2=0.3),且常温下甲、丙、丁均可与乙反应。下列说法正确的是
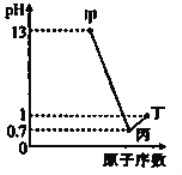
A. 原子半径:A<B<C<D
B. A、B分别与D形成的化合物均为离子化合物
C. B、C的简单离子都会影响水的电离平衡
D. 乙在浓氨水中能溶解
难度: 困难查看答案及解析
-
根据原子结构及元素周期律的知识,下列说法正确的是
A. 由反应Na+KCl===NaCl+K↑可知,金属性:Na>K
B. 某元素原子核外的电子数为53,则它位于第五周期Ⅶ族
C. 第ⅥA族元素的简单气态氢化物中,稳定性最强的,其沸点也最高
D. 第二周期元素随族序数的递增,其最高化合价也递增
难度: 中等查看答案及解析
-
实验是化学研究的基础,关于下列各实验装置的叙述中正确的是
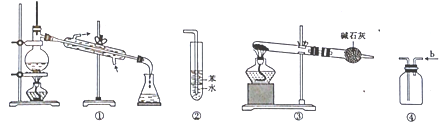
A. 装置①常用于分离互不相溶液体混合物
B. 装置②可用于吸收HCl气体,并防止倒吸
C. 以NH4HCO3为原料,装置③可用于实验室制备少量NH3
D. 装置④b口进气,用排空气法可收集CO2、NO等气体
难度: 中等查看答案及解析
-
下列实验中,对应的操作、现象以及所得出的结论都正确的是
选项
实验
现象
结论
A
把铝箔插入浓硝酸中
有大量红棕色气体产生
浓硝酸具有强氧化性
B
CO2通入CaCl2溶液中
无明显现象
非金属性:Cl>C
C
Cl2通入品红溶液中
品红褪色
Cl2具有漂白性
D
NaOH溶液中逐滴滴入0.1mol·L−1MgSO4溶液至不再有沉淀产生,再滴0.1mol·L-1CuSO4溶液
先有白色沉淀生成,后白色沉淀变为浅蓝色沉淀
Ksp[Cu(OH)2]<Ksp[Mg(OH)2]
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知在酸性介质中,MnSO与(NH4)2S2O8(过二硫酸铵)溶液会发生反应:Mn2++S2O82—→MnO4—+SO42—,下列说法正确的是,
A. 反应过程中,因消耗溶液中的H+反应后溶液pH增大
B. 氧化性:S2O82—> MnO4—
C. 该反应中酸性介质可以为盐酸
D. 0.1mol氧化剂参加反应,转移电子0.5mol
难度: 困难查看答案及解析
-
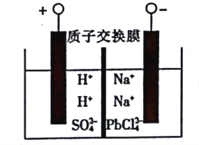
以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理如图。下列说法正确的是
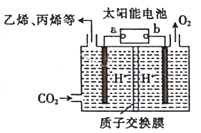
A. a电极为太阳能电池的正极
B. 产生丙烯的电极反应式为:3CO2+18H++18e—===6H2O+CH3CH=CH2
C. 装置中每转移2mole—,理论上有2molH+通过质子交换膜从左向右扩散
D. 太阳能电池的原理与原电池的原理相同
难度: 简单查看答案及解析
-
已知H2C2O4是二元弱酸,室温下向某浓度的草酸溶液中逐滴加入KOH溶液,所得溶液中H2C2O4、HC2O4—、C2O42—的组成百分率与pH的关系如图所示,下列说法正确的是
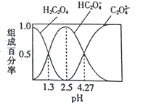
A. pH=4.27的溶液中:c(K+)+c(H+)=c(OH)+3c(C2O42—)
B. 反应HC2O4—+H2O
H2C2O4+OH—的平衡常数为10-4.27
C. 向溶液中加入KOH溶液将pH由1.3调至4.27的过程中水的电离程度先增大后减小
D. pH=2.5的溶液中:c(H+)+2c(H2C2O4)=c(OH—)+c(C2O42—)
难度: 困难查看答案及解析