-
化学与生活密切相关。下列有关说法错误的是( )
A. 用灼烧的方法可以区分蚕丝和人造纤维
B. 食用油反复加热会产生稠环芳烃等有害物质
C. 福尔马林可浸制标本,因其可使蛋白质变性的性质
D. 医用消毒酒精中乙醇的浓度为95%
难度: 简单查看答案及解析
-
下列说法中不正确的是( )
A. 氟化银可用于人工降雨 B. 从海水中获取食盐不需要化学变化
C. FeCl3溶液可用于制作印刷电路板 D. 绿矾可用来生产铁系列净水剂
难度: 中等查看答案及解析
-
下列反应中,金属元素被氧化的是
A. 2FeCl2+Cl2=2FeCl3 B. H2+CuO
Cu+H2O
C. Na2O+H2O=2NaOH D. 2KMnO4
K2MnO4+MnO2+O2↑
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A. 氯气可用于合成药物 B. 碳酸钠可用于治疗胃酸过多
C. 高压钠灯常用来广场照明 D. 镁合金密度小强度大可用于制飞机零部件
难度: 简单查看答案及解析
-
下列反应的离子方程式的书写正确的是
A. 氧化钠投入水中:O2-+H2O=2OH-
B. FeCl3溶液与KI反应:2Fe3++2KI=2Fe2++I2+2K+
C. 过量硫酸氢铵与氢氧化钡反应:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O
D. 过量CO2 通入到 NaClO溶液中:H2O+CO2+2ClO-=2HClO+CO32-
难度: 中等查看答案及解析
-
恒温条件下,在体积不变的密闭容器中,有可逆反应X(s)+2Y(g)
2Z(g) △H<0,下列说法—定正确的是
A. 0.2molX和0.4molY充分反应,Z的物质的量可能会达到0.35mol
B. 从容器中移出部分反应物X,则正反应速率将下降
C. 当△H不变时,反应将达到平衡
D. 向反应体系中继续通入足量Y气体,X有可能被反应完全
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 常温下,22 g CO2所含的共用电子对数目为NA
B. 标准状况下,22.4 L NO 与11.2 L O2混合后气体中分子总数小于NA
C. 将1 L 0.1 mol·L-1 FeCl3溶液滴入沸水中,制得的Fe(OH)3胶粒数目为0.1NA
D. 常温下,1 L 0.5 mol·L-1 NH4Cl溶液与2 L 0.25 mol·L-1 NH4Cl溶液中的NH4+数目相同
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 无色透明溶液中: Zn2+、SO42-、NH4+,Cl-
B. 0.1mol/L NaHCO3溶液中: Mg2+、Al3+、K+、NO3-
C. 能使甲基橙变黄的溶液中: Na+,CH3COO-、 MnO4-、 Fe3+
D. c(H+)/c(OH-)=1×1012的溶液中:NO3-、I-、K+、Fe2+
难度: 中等查看答案及解析
-
工业上用铋酸钠(NaBiNO3)检验溶液中的Mn2+,反应方程式为:4MnSO4+10NaBiO3+14H2SO4=4NaMnO4+5Bi(SO4)3+3Na2SO4+□,下列说法不正确的是( )
A. “□”内的物质为水,配平系数为14 B. 若生成1mol NaMnO4,则转移5mole-
C. 反应方程式中的硫酸可换为盐酸 D. 溶液中有Mn2+的现象是溶液变为紫红色
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是
选项
操作
现象
结论
A
向某溶液中加入NaOH 溶液,并将红色石蕊试纸置于溶液中
试纸变蓝
原溶液中有NH4+
B
向苏打和小苏打溶液中分别加入盐酸
均冒气泡
两者均能与盐酸反应
C
向某溶液中滴加氯水后,再加KSCN溶液
溶液变红
该溶液中一定有Fe3+
D
向某无色溶液中滴加BaCl2溶液
产生白色沉淀
该无色溶液中一定含有SO42-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A. 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O===HClO+HSO3-
B. 0.1 mol/L NH4Al(SO4)2溶液与0.2 mol/L Ba(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-=2BaSO4+AlO2-+2H2O
C. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
D. Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O
难度: 中等查看答案及解析
-
将0.2 mol KMnO4在一定温度下加热后生成a mol O2;将剩余固体与过量浓盐酸混合加热又生成b mol Cl2,此时锰元素均以Mn2+形式存在。若a+b=m,则m的值可能为( )
A. 0.30 B. 0.35
C. 0.40 D. 0.50
难度: 中等查看答案及解析
-
实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
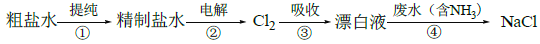
下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
难度: 中等查看答案及解析
-
如图所示,一密闭气缸被一不漏气但可滑动的活塞隔开分成两部分。反应前,左边充有N2,右边充有H2、O2的混合气体;20℃时,将右边混合气体点燃,反应后冷却到20℃,若活塞最终静置于气缸的中央(液体体积忽略不计)。则反应前容器中N2和O2的物质的量之比可能为
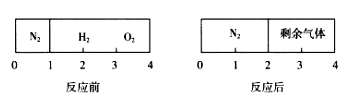
A. 3:5 B. 5:4 C. 2:7 D. 2:5
难度: 中等查看答案及解析

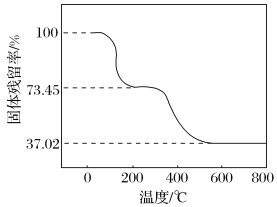
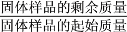 ×100%)随温度的变化如下图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。
×100%)随温度的变化如下图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。