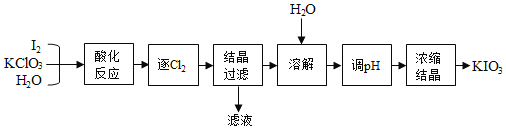
-
NA代表阿伏伽德罗常数的数值,下列说法正确的是
A. 25℃时,7g C2H4和C3H6的混合气体中,含有NA个C-H键
B. 0.25mol Na2O2中含有的阴离子数为0.5NA
C. 50mL 18.4 mol·L−1浓硫酸与足量铜微热,生成气体的分子数为0.46NA
D. 常温常压下,1mol氦气含有的核外电子数为4NA
难度: 困难查看答案及解析
-
洁厕灵与“84”消毒液混合会产生氯气:2HCl+NaClO===NaCl+Cl2↑+H2O,下列说法错误的是
A. NaClO作氧化剂 B. n(氧化剂) ∶n(还原剂)=1∶2
C. 氧化性:NaClO>Cl2 D. Cl2既是氧化产物又是还原产物
难度: 简单查看答案及解析
-
有关100mL 0.1mol/L K2SO4溶液的叙述正确的是( )
A. 含有0.1molK2SO4 B. 水的体积为0.1L
C. c(K+)=0.2 mol/L D. 取出10mL溶液,c(K2SO4)=0.01mol/L
难度: 简单查看答案及解析
-
下列关于钢铁发生吸氧腐蚀的分析正确的是
A. 吸氧腐蚀是吸热反应
B. 铁作原电池正极
C. 正极电极反应为:2H2O+O2+4e—═4OH—
D. 原电池负极反应为:Fe﹣3e—═Fe3+
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 常温常压下,8.8g CO2和N2O混合气体中所含的电子数为4.4NA
B. 常温下,pH=1的硫酸溶液所含氢离子数约为0.1NA
C. 6.72L NO2与水充分反应转移的电子数目为0.2NA
D. 64g铜丝加热下在硫磺蒸气里完全反应后,失去的电子数为2NA
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,22.4L四氯化碳中含共价键数目为4NA
B. 常温下,46g NO2、N2O4组成的混合气体中所含有的分子数为NA
C. 36g 18O2中含有的中子数目为20NA
D. 2.24 L Cl2(标准状况)与足量铁反应时,转移电子数目为0.3NA
难度: 中等查看答案及解析
-
有7瓶氯盐溶液,阳离子分别是Cu2+、Fe3+、Al3+、Mg2+、Fe2+、NH4+、Na+等离子的溶液,只用一种试剂即可鉴别,该试剂可能是
A. KMnO4溶液 B. KSCN溶液 C. NaOH溶液 D. NH3·H2O溶液
难度: 中等查看答案及解析
-
取xg铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8960 mL的NO2气体和672mLN2O4的气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02g。则x等于( )
A. 8.64g B. 9.20g C. 9.00g D. 9.44g
难度: 简单查看答案及解析
-
下列各图所示装置的气密性检查中,一定漏气的是 ( )
A.
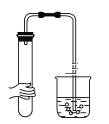 B.
B.  C.
C. 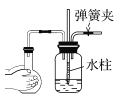 D.
D. 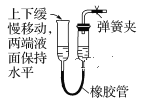
难度: 中等查看答案及解析
-
如图是某学校购买的硫酸试剂标签上的部分内容。据此下列说法正确的是

A. 该硫酸的物质的量浓度为1.84mol·L−1
B. 1mol Zn与足量的该硫酸反应产生2g H2
C. 配制200mL4.6mol·L−1的稀硫酸需取该硫酸50mL
D. 该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol·L−1
难度: 中等查看答案及解析
-
下述转化关系可用于合成解痉药奥昔布宁的前体(化合物丙)。下列说法正确的是
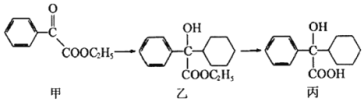
A. 化合物甲中的含氧官能团有羰基和酯基
B. 化合物乙与NaOH水溶液在加热条件下反应可生成化合物丙
C. 化合物乙不能发生消去反应
D. 化合物丙能和FeCl3溶液发生显色反应
难度: 中等查看答案及解析
-
下列叙述中,含有的分子数最多的是
A. 2mol H2 B. 6.02×1023个Cl2分子 C. 22.4L O2(标准状况下) D. 49g H2SO4
难度: 中等查看答案及解析
-
一种新药物结构如图所示,下列有关该化合物说法正确的是
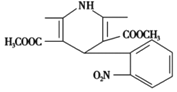
A. 分子式为C17H17N2O6
B. 能发生水解反应、聚合反应、取代反应
C. 能与氢气发生加成反应,但不能与溴的四氯化碳溶液反应
D. 分子中含有三种不同的官能团
难度: 中等查看答案及解析
-
下列解释事实的化学方程式或离子方程式中不正确的是
A. 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH—=SiO32—+H2O
B. 用过氧化氢从酸化的海带灰浸出液中提取碘:2H++2I—+H2O2=I2+2H2O
C. 燃煤时加入适量石灰石粉末,可减少SO2的排放:2CaCO3+2SO2+O2
2CaSO4+2CO2
D. 强碱溶液中,用次氯酸钠与Fe(OH)2反应制备高铁酸钠:2ClO—+ Fe(OH)2=FeO42—+2Cl—+2H+
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A. 将 Cl2 通入水中: Cl2+H2O
2H++Cl-+ClO-
B. 向 Fe2(SO4)3 溶液中加入过量铁粉: Fe3++Fe=2Fe2+
C. 将 SO2 通入双氧水中: SO2+H2O2=2H++SO42-
D. 向 Na2SiO3 溶液中滴加稀盐酸: Na2SiO3+2H+=H2SiO3↓+2Na+
难度: 简单查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A. 含有大量NO
的溶液:H+、K+、Cl—、SO32—
B. 中性溶液:Fe3+、Al3+、NO3—、SO42—
C.
=1×10—12的溶液:K+、AlO2—、CO32—、Na+
D. 由水电离出的c(H+)=10—12 mol·L−1的溶液:Na+、K+、CO32—、SO42—
难度: 中等查看答案及解析
-
铁棒与石墨用导线连接后,浸入0.01 mol·L−1的食盐溶液中(如图所示),下列说法正确的是
A. 铁棒是阴极 B. 石墨附近产生OH— C. 石墨上有Cl2放出 D. 铁棒上有H2放出
难度: 中等查看答案及解析
-
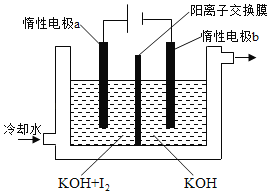
某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,负极材料采用pt,正极材料采用MnO2(既作电极材料又对该极的电极反应具有催化作用),该电池可用作卫星、深水勘探等无空气环境电源,其工作原理如图所示。下列说法不正确的是
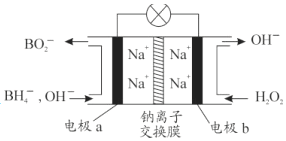
A. 每消耗3mol H2O2,转移6mol e—
B. 电池工作时Na+从b极区移向a极区
C. a极上的电极反应式为:BH4—+8OH—-8e—===BO2—+6H2O
D. b极材料是MnO2,该电池总反应方程式:NaBH4+4H2O2===NaBO2+6H2O
难度: 中等查看答案及解析
-
NH4N3(叠氮化铵)易发生爆炸反应:NH4N3 = 2N2↑+2H2↑,NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A. 1.8g NH4+中含有的质子数为1NA
B. N2既是氧化产物,又是还原产物
C. 爆炸反应中,当转移4NA个电子时,产生89.6L(标准状态)混合气体
D. 6g的NH4N3晶体中含有的阴离子个数为0.3NA
难度: 中等查看答案及解析
-
某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。下列方框中对应的物质或有关叙述正确的是( )
A. Na2S4O6、H2O、Na2S2O3、Au2O、NaOH B. Na2S2O3、NaOH、Na2S4O6、Au2O、H2O
C. Na2S2O3、H2O、Na2S4O6、Au2O、NaOH D. 当1 mol Au2O3完全反应时,转移电子8mol
难度: 中等查看答案及解析