-
下列溶液中不能盛放在玻璃瓶中的是( )
A. 新制氯水 B. 硅酸钠溶液 C. 氢氧化钠溶液 D. 氢氟酸
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊溶液褪色
B. 能使品红溶液褪色的不一定是SO2
C. SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同
D. SO2和Cl2等物质的量混合后同时通入装有湿润的有色布条的集气瓶中,漂白效果更好
难度: 中等查看答案及解析
-
下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥ 浓HNO3,其中在一定条件下能与SiO2反应的有( )
A. ①②⑥ B. 全部 C. ①③④⑤ D. ②③⑥
难度: 简单查看答案及解析
-
在PH=1的无色溶液中一定可以大量共存的离子组是( )
A. Al3+ Na+ NO3- Cl- B. K+ Na+ Cl- MnO4-
C. K+ Na+ Cl- AlO2- D. K+ NH4+ SO42- SiO32-
难度: 中等查看答案及解析
-
下列离子反应方程式正确的是( )
A. FeSO4溶液中通入Cl2:Fe2++Cl2==Fe3++2Cl-
B. 氨水滴入AlCl3溶液中:Al3+ + 3OH― == Al(OH)3↓
C. Fe2O3溶于足量HI溶液中:Fe2O3+ 6H+ == 2Fe3+ +3H2O
D. 二氧化碳通入“水玻璃”中:CO2 + SiO32― + H2O == CO32―+ H2SiO3↓
难度: 中等查看答案及解析
-
以下物质间的每步转化通过一步反应能实现的是( )
A. Na-Na2O2-Na2CO3-NaOH B. Si-SiO2-H2SiO3-Na2SiO3
C. S-SO3-H2SO4-MgSO4 D. Al-Al2O3-Al(OH)3-NaAlO2
难度: 困难查看答案及解析
-
证明某溶液只含有Fe 2+而不含Fe 3+的实验方法是( )
A. 只需滴加KSCN溶液
B. 先滴加氯水,再滴加KSCN溶液后显红色
C. 先滴加KSCN溶液,不显红色,再滴加氯水后显红色
D. 滴加NaOH溶液,产生红褐色沉淀。
难度: 困难查看答案及解析
-
只含SiO2杂质的石灰石样品,在高温下熔烧得到的残留物经检验为一纯净物,则原样品中SiO2的质量分数为( )
A. 28.5% B. 37.5% C. 40% D. 62.5%
难度: 中等查看答案及解析
-
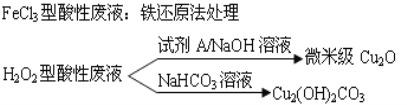
蛇纹石由MgO、A12O3、SiO2、Fe2O3组成。现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加入NaOH溶液至过量。下列叙述不正确的是
A. 沉淀X的成分是SiO2
B. 将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3
C. 在溶液Y中加入过量的NaOH溶液,过滤得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2
D. 溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
难度: 中等查看答案及解析
-
现有MgCl2、AlCl3、CuSO4、FeCl3、NH4NO3五种溶液,如果只用一种试剂把它们鉴别开来,应选用的试剂是( )
A. 氨水 B. AgNO3 C. KSCN溶液 D. 浓NaOH
难度: 中等查看答案及解析
-
对某酸性溶液(可能含有Br-,SO42-, H2SO3,NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸
对于下列物质不能确认其在溶液中是否存在的是 ( )
A. Br- B. SO42- C. H2SO3 D. NH4+
难度: 中等查看答案及解析
-
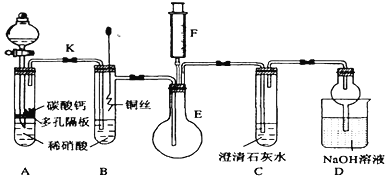
向盐酸中加浓H2SO4时,会有白雾生成,不是导致产生该现象的原因是
A. 浓H2SO4具有脱水性
B. 浓H2SO4具有吸水性
C. 盐酸具有挥发性
D. 气态溶质的溶解度随度随温度的升高而降低
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下面叙述正确的是 ( )
A. 标准状况下,11.2L SO3所含分子数为0.5 NA
B. 常温下,64g二氧化硫含有原子数为3NA
C. 1L 1mol/L的氯化钠溶液中,所含离子数为NA
D. 常温下,向含有足量浓H2SO4的烧杯中加入1mol铁后,铁失去的电子数为3NA
难度: 中等查看答案及解析
-
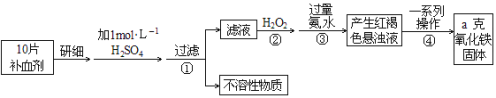
下列除去杂质的方法正确的是( )
A. 除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B. 除去CO2中的少量SO2:通入Na2CO3溶液,收集气体
C. 除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D. 除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
难度: 中等查看答案及解析
-
某溶液中有Na+、Mg2+、SO32-、Cl-、SO42-五种离子,若向其中加入过量的过氧化钠,微热并搅拌,冷却后再加入过量盐酸,溶液中离子的物质的量基本保持不变的是
A. Na+ B. Cl- C. SO42- D. Mg2+
难度: 中等查看答案及解析
-
NH3是一种重要的化工原料,可以制备一系列物质(见右图),下列说法正确的是

A. NH4Cl和NaHCO3都是常用的化肥
B. NH4Cl、NaHCO3和Na2CO3受热时都易分解
C. NH3和NO2在一定条件下可发生氧化还原反应
D. 图中所涉及的盐类物质均可与Ca(OH)2发生反应
难度: 简单查看答案及解析