-
下列对化学反应的认识错误的是( )
A.一定会有新物质生成 B.一定伴随着能量的变化
C.可能会引起物质状态的变化 D.有化学键破坏的一定是化学反应
难度: 简单查看答案及解析
-
关于化学反应与能量的有关说法正确的是( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.化学键断裂时吸收能量,化学键形成时放出能量
D.化学反应中的能量变化都表现为热量的变化
难度: 中等查看答案及解析
-
下列变化中,属于吸热反应的是( )
①液态水汽化; ②胆矾加热变为白色粉末;③浓硫酸稀释;
④氯酸钾分解制氧气;⑤碳与氧气反应生成一氧化碳。
A.①③⑤ B.②④ C.①② D.①②④
难度: 中等查看答案及解析
-
已知:2Zn(s)+O2(g)=2ZnO(s) △H=-701.0kJ/mol
2Hg(l)+O2(g)= 2HgO(s) △H=-181.6kJ/mol
则反应 Zn(s)+HgO(s)=ZnO(s)+Hg(l)的△H为( )
A.+519.4kJ/mol B.+259.7kJ/mol C.-519.4kJ/mol .D.-259.7kJ/mol
难度: 中等查看答案及解析
-
白磷和红磷都是磷元素的单质,已知31g红磷完全转化成白磷时,要吸收E kJ的能量,下列说法正确的是( )
A.白磷不如红磷稳定
B.等质量时,红磷能量高于白磷
C.红磷转化成白磷不属于化学变化
D.等质量的红磷与白磷完全燃烧,白磷放出的能量少
难度: 中等查看答案及解析
-
下列情况下,反应速率相同的是( )
A.等体积0.1mol/L H2SO4和0.2 mol/L HNO3分别与等质量铜片反应
B.等质量的锌粒和锌粉分别与等体积1 mol/L H2SO4反应
C.等体积0.2 mol/L HCl和0.1 mol/L H2SO4分别与等质量相同形状石灰石反应
D.等体积0.1 mol/L HCl和0.1mol/L HNO3分别与等质量Al2O3粉末反应
难度: 中等查看答案及解析
-
设:C (g)+H2O(g)
CO(g)+H2(g)△H>O,反应速率为v1;2SO2(g)+O2(g
2SO3(g) △H<0,反应速率为v2。当温度升高时,v1和v2的变化情况为( )
A.同时增大 B.同时减小 C.v1增大,v2减小 D.v1减小,v2增大
难度: 简单查看答案及解析
-
下列与活化能有关的说法明显错误的是( )
A.对有气体参加的化学反应,增大压强体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大
B.升高温度,一般可使反应所需的活化能降低,导致反应速率增大
C.有效碰撞一定为活化分子之间发生的碰撞
D.加入适宜的催化剂,可使活化分子的百分数大大增加,从而增大化学反应的速率
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
A.由NO2(g)和N2O4(g)组成的平衡体系升高温度后颜色变深
B.实验室中用氯化钠固体与浓硫酸共热制取HCl气体
C.实验室可用碳酸钙粉末和稀盐酸制得CO2气体
D.实验室用排饱和食盐水的方法收集Cl2
难度: 中等查看答案及解析
-
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+ Y(g)
Z(g)+W(s) △H>0;下列叙述正确的是( )
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.若升高温度,平衡向逆反应方向移动
D.平衡后加入X,上述反应的△H增大
难度: 中等查看答案及解析
-
①酸的浓度和体积;②碱的浓度和体积;③比热容:④反应后溶液的质量;⑤生成水的物质的量;⑥反应前后温度变化;⑦操作所需的时间。
A. ③④⑤⑥ B. ①③④⑤ C. ①②③⑥ D. 全部
难度: 中等查看答案及解析
-
根据键能数据估算CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热△H为( )
化学键
C-H
C-F
H-F
F-F
键能/(kJ/mol)
414
489
565
155
A.+485kJ/mol B.-485kJ/mol C.+1940kJ/mol D.-1940kJ/mol
难度: 中等查看答案及解析
-
已知十水碳酸钠溶于水时溶液温度升高,室温下将1mol碳酸钠制成溶液时放出热量为Q1 kJ,又知十水碳酸钠分解的热化学方程式为:Na2CO3·10H2O(s)
Na2CO3 (s)+10H2O(1) △H = +Q2kJ/mol(Q2>0)则Q1和Q2的关系为( )
A.Q1>Q2 B.Q1<Q2 C.Q1=Q2 D.无法确定
难度: 中等查看答案及解析
-
对于可逆反应N2(g)+3H2(g)
2NH3(g) △H<0,下列研究目的和图示相符的是()
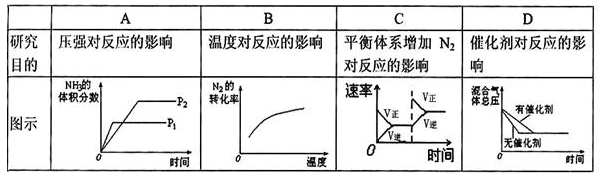
难度: 中等查看答案及解析
-
一定条件下,通过下列反应可以制取氯化硫酰( SO2Cl2):SO2(g)+Cl2(g)
SO2C12(l) △H<0,在恒压密闭容器中,加入1mol SO2和1mol Cl2,反应达到平衡后,当其他条件不变时,下列说法正确的是( )
A.再加入1mol SO2和1mol Cl2,重新达到平衡后,Cl2浓度和原平衡时相等
B.升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.通入Ar气,使容器压强增大,可同时提高SO2和Cl2的转化率
D.分离出部分SO2Cl2,正反应速率增大,平衡向正反应方向移动
难度: 困难查看答案及解析
-
对于反应:4HCl(g)+O2(g)
2Cl2(g)+2H2O(g),下图是两种投料比[n(HCl):(O2)分别为4:1和2:1]下,反应温度对HCl平衡转化率影响的曲线。则投料比为4:1、溺度为400℃时,平衡混合物中Cl2的体积分数是( )
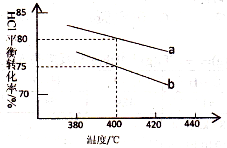
A.
B.
C.
D.
难度: 困难查看答案及解析
-
对于反应X(g)
4Y(g)+Z(g) △H<0,某温度时X的浓度随时间变化曲线如图,下列有关该反应的描述正确的是( )

A.第6min后,该反应就停止了
B.X的平衡转化率为15%
C.若增大压强,X的平衡转化率将减小
D.若升高温度,X的平衡转化率将增大
难度: 困难查看答案及解析
-
如图所示,甲容器容积不变,乙容器有可移动活塞。甲中充入3 molA和2 moI B,乙中充入2 molC和2 mol D,发生反应:3A(g)+2B(s)
C(g)+D(g) △H >0。在相同温度下反应达到平衡,活塞移动到4处。下列有关说法正确的是( )
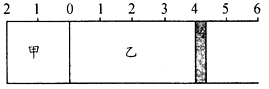
A.平衡后,容器内压强:P甲<P乙
B.平衡后,若向乙中再加入B物质,活塞向右移动
C.平衡后,若将活塞移动至3处,乙中c(A)、c(D)均增大
D.同时升高相同温度,达到新平衡时,甲中A物质的速率等于乙中A物质的速率
难度: 困难查看答案及解析
-
向容积固定为2L的密闭容器中充入9.6mol NO和4.8molO2,发生如下反应:
①2NO(g)+O2(g)
2NO2(g) △H<0
②2NO2(g)
N2O4(g) △H<0
测得反应达到平衡时NO2浓度为1.2 mol/L,N2O4的浓度为0.8 mol/L。则反应①的化学平衡常数为( )
A. 0.24 B.0.36 C.1.44 D.l.96
难度: 中等查看答案及解析