-
氮、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式:
口H2PO2-+口Ag++口________=口PO43-+口Ag+口________
(2)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44℃,沸点280℃),主要生产流程如下:
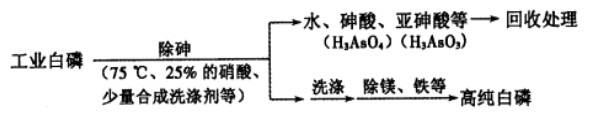
①关于除砷条件的说法合理的是__________(填字母)。
a.75℃使白磷熔化,并溶于水 b.硝酸浓度不易过大,防止白磷反应
c.温度不易过高,防止硝酸分解 d.适当提高温度,加快化学反应速率
②硝酸氧化除砷时被还原为NO,氧化相同质量的砷.当转化为亚砷酸的量越多,消耗硝酸的量越 _____________(填“多”或“少”)。
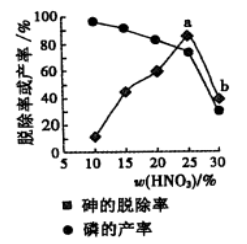
③某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如右图,砷的脱除率从a点到b点降低的原因是_____________。
(3)某温度下,已知:
Ag+(aq)+2NH3(aq)  Ag(NH3)2+(aq) k1=1.10×107
Ag(NH3)2+(aq) k1=1.10×107
AgCl(s) Ag+(aq)+Cl-(aq) K2=1.45×10-10
Ag+(aq)+Cl-(aq) K2=1.45×10-10
①反应平衡常数的表达式K1=______________。
②计算可逆反应AgCl(s)+2NH3(aq) Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=___________(保留2位有效数字)。
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=___________(保留2位有效数字)。
③1Llmol/L氨水中最多可以溶解AgCl__________mol(保留1位有效数字,忽略溶液体积变化)。
-
铜、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)磷的一种化合物叫亚磷酸(H3PO3),已知:
Ⅰ.0.1 mol/L H3PO3溶液的pH=1.7;
Ⅱ.H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3两种盐;
Ⅲ.H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3溶液有黄色沉淀生成.
① 关于H3PO3的说法:A.强酸;B.弱酸;C.二元酸;D.三元酸;e.氧化性酸;f.还原性酸,其中正确的是 。
② 写出H3PO3与少量NaOH溶液反应的离子方程式 。
③ Na2HPO3 为__________________(填“正盐”或“酸式盐”)。
(2)碘化亚铜可作催化剂、饲料添加剂等,是难溶于水的固体.铜可以与氢碘酸发生置换反应得到氢气,试从离子浓度对离子反应方向影响的角度解释此反应能够发生的原因 ,CuSO4溶液也能使淀粉﹣KI试纸变蓝,用离子方程式说明其原理 。
(3)纳米氧化亚铜是一种具有良好光电效应的材料,工业上制备它的方法之一是:先向KOH溶液中加入一定量的CuSO4溶液,再加入一定量的肼(N2H4),加热并保持反应体系的温度在90℃,反应完全后,分离、洗涤、真空干燥所得到的固体样品.检验反应混合体系内纳米Cu2O已经生成的实验方法的名称是 。
-
铜、磷及其化合物在生产、生活中有重要的用途,回答下列问题:
(1)磷的一种化合物叫亚磷酸(H3PO3)。已知:
Ⅰ、0.1mol/L H3PO3溶液的pH=1.7;
Ⅱ、H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3两种盐;
Ⅲ、H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成.
①关于H3PO3的说法:a强酸;b弱酸;c二元酸;d三元酸;e氧化性酸;f还原性酸,其中正确的是__________
A.bdf B.bcf C.ade D.bce,
②写出H3PO3与少量NaOH溶液反应的离子方程式__________;
③Na2HPO3为__________(填“正盐”或“酸式盐”)
(2)碘化亚铜可作催化剂,饲料添加剂等,是难溶于水的固体.铜可以与氢碘酸发生置换反应得到氢气,试从离子浓度对离子反应方向影响的角度解释此反应能够发生的原因__________,CuSO4溶液也能使淀粉-KI试纸变蓝,用离子方程式说明其原理__________;
(3)纳米氧化亚铜是一种具有良好光电效应的材料,工业上制备它的方法之一是:先向KOH溶液中加入一定量的CuSO4溶液,再加入一定量的肼(N2H4),加热并保持反应体系的温度在90℃,反应完全后,分离、洗涤、真空干燥所得到的固体样品。检验反应混合体系内纳米Cu2O已经生成的实验方法的名称是__________。
-
磷的单质和化合物都是重要的化工产品。查阅资料可知:亚磷酸(H3PO3)、次磷酸(H3PO2)以及它们的盐都有较强的还原性,可用于化学镀银或镀镍。亚磷酸是中强酸,它与足量的NaOH溶液反应生成 Na2HPO3。试回答下列问题:
(1)Na2HPO3中P的化合价为____。
(2)Na2HPO3是____(填“正盐”或“酸式盐”),其溶液的pH____(填“>”、“=”或“<”)7。
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。镀镍溶液中含Ni2+和H2PO2-,在酸性条件下发生下述反应: Ni2++ H2PO2-+ = Ni+ H2PO3-+_____。
①请配平化学方程式___。
②依据化学方程式,反应消耗6 mol H2PO2-时,转移电子数为_____。
-
氮、磷及其化合物在生产、生活中有重要的用途.回答下列问题:
(1)磷酸是三元中强酸,将磷酸加强热时可发生分子间的脱水生成焦磷酸(H4P2O7)、三聚磷酸(H5P3O10)以至直链多聚磷酸.当直链多聚磷酸分子中P原子数为20时,其化学式是_________.直链多聚磷酸常用于制取阻燃剂
(2)PH3是一种性能良好的熏蒸剂,用于除治储藏物害虫.
①与同主族元素的氢化物NH3相比,沸点:PH3 ___NH3(填“<”或“>”或“=”);稳定性:PH3 __NH3(填“<”、“>”或“=”); 实验室制取PH3可选用PH4I与______(填物质类别)反应得到.
②PH3气体发生器中常用磷化铝水解,其化学反应方程式是_____________.
(3)利用葡萄糖与银氨溶液反应在热水瓶胆内壁镀银.查阅资料可知:银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)⇌Ag(NH3)2+(aq),该反应平衡常数K稳[Ag(NH3)2+]=1.10×107,又已知Ksp[AgCl]=1.45×10﹣20.计算可逆反应AgCl(s)+2NH3(aq)⇌Ag(NH3)2+(aq)+Cl﹣(aq)的化学平衡常数K=________(保留2位有效数字),1L 1mol/L氨水中最多可以溶解AgCl____mol(保留2位有效数字).
(4)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示.
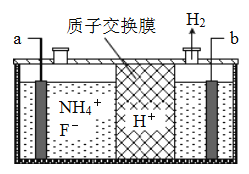
a电极为电解池的___(填“阴”或“阳”)极,其电极反应式为____________________;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是______.
-
在工业上次磷酸(H3PO2)常用于化学镀银,发生的反应如下:____Ag++___ H3PO2+___H2O→____Ag↓+____ H3PO4+___H+
请回答下列问题:
(1)H3PO2中,P元素的化合价为_____;该反应中,H3PO2作_____(填“氧化剂”或“还原剂”)。
(2)上述离子方程式中,各物质的化学计量数分别为___________。
(3)若反应中生成10.8g Ag,则转移的电子数为__________。
(4)H3PO2是一元中强酸,写出其与足量NaOH 溶液反应的离子方程式:________。
-
氮和氮的化合物在工农业生产、国防和生活中都有极其广泛的用途。请回答下列与氮元素有关的问题:
(1)亚硝酸氯(结构式为Cl-N=O)是有机合成中的重要试剂,可由Cl2和NO在一定条件下通过以下反应制得:2NO+Cl2=2ClNO,已知几种化学键的键能数据如下表所示:
| 化学键 | Cl-Cl | Cl-N | N=O | N=O(NO) |
| 键能(kJ·mol-1) | 243 | a | 607 | 630 |
请根据表中数据计算:2NO(g)+Cl2(g)=2ClNO(g)△H=___kJ•mol-1。
(2)温度一定时,在一个体积为1L的密闭容器中通入2molNO和1molCl2,10min时ClNO体积占气体总体积40%(气体的“体积分数”即“物质的量分数”),则反应开始到10min内NO的平均反应速率:v(NO)=___mol·L-1·min-1
(3)以NH3为还原剂在脱硝装置中消除烟气中的氮氧化物,
主反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g) △H1
副反应:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1267.1kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-907.3kJ/mol
①△H1=___。
②将烟气按一定的流速通过脱硝装置,测得出口NO的浓度与温度的关系如图1,试分析脱硝的适宜温度是___(填序号)
a.<850℃ b.900~1000℃ c.>1050 ℃

(4)以连二亚硫酸盐(S2O42-)为还原剂脱除烟气中的NO,并通过电解再生,装置如图2。阴极的电极反应式为___。

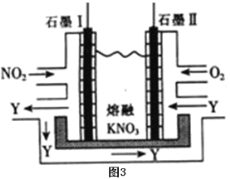
(5)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,装置如图3所示,电池工作时,NO2转变成绿色硝化剂Y(N2O5),可循环使用,则石墨Ⅰ附近发生的电极反应式为:___。
-
(16分)铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为________。
(2)SO42ˉ的立体构型是________,其中S原子的杂化轨道类型是________。
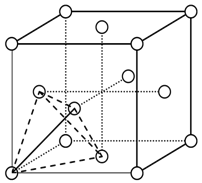
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子外围电子排布式为________。一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为________,该晶体中,原子之间的作用力是________。
(4)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中心(如下图),该晶体储氢后的化学式应为________;假设在另一条件下,氢原子可进入到由Cu原子与Au原子构成的八面体空隙中心,该晶体储氢后的化学式为________。(提示:查找四面体、八面体时,需假设Cu原子与Au原子等同;每个四面体、八面体内只填充一个氢原子)
-
(10分)铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为___________;
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是_______;
(3)SO42-的立体构型是________,其中S原子的杂化轨道类型是_______;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为__________。
-
(12分)次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,具有较强还原性。回答下列问题:
(1)H3PO2及NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①在H3PO2中,磷元素的化合价为 ;在酸性环境中,利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,则氧化产物为: (填化学式)。
②NaH2PO2是 (填“正盐”还是“酸式盐”),其溶液中离子浓度由大到小的顺序应为
③0.2 mol·L-1 H3PO2溶液与0.2mol·L-1NaOH溶液等体积混合后所得溶液中:
c(H2PO2-)+c(OH-)-c(H+)= mol·L-1。(溶液体积变化忽略不计)
(2)次磷酸(H3PO2)可以通过电解的方法制备。工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
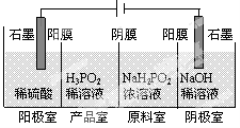
①写出阳极的电极反应式
②分析产品室可得到H3PO2的原因 (用离子方程式表示)


Ag(NH3)2+(aq) k1=1.10×107
Ag+(aq)+Cl-(aq) K2=1.45×10-10
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=___________(保留2位有效数字)。





