-
(13分)铜(Cu)是重要金属,铜的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)向CuSO4浓溶液中滴入浓氨水,直至产生的沉淀恰好溶解,可得到深蓝色的透明溶液。再向其中加入适量乙醇,可析出深蓝色的Cu(NH3)4SO4•H2O晶体。
①沉淀溶解的离子方程式为_______________________________________________。
②乙醇的作用是_________________________________________________________。
③[Cu(NH3)4]2+具有对称的立体构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的立体构型为____________________,其中N原子的杂化轨道类型是________。
(2)金(Au)与铜为同族元素,铜与金可形成具有储氢功能的合金。
①合金中,原子间的作用力是_______________。已知Au为第六周期元素,则基态Au原子的价电子排布式为________,Au的原子序数为________。
②该储氢合金为立方最密堆积结构,晶胞中Cu原子位于面心、Au原子位于顶点,储氢时,H原子进入由Cu原子与Au原子构成的四面体空隙中,则该晶体储氢后的化学式为_______________。
-
(16分)铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为________。
(2)SO42ˉ的立体构型是________,其中S原子的杂化轨道类型是________。
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子外围电子排布式为________。一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为________,该晶体中,原子之间的作用力是________。
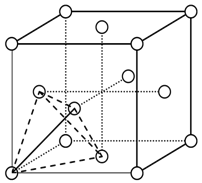
(4)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中心(如下图),该晶体储氢后的化学式应为________;假设在另一条件下,氢原子可进入到由Cu原子与Au原子构成的八面体空隙中心,该晶体储氢后的化学式为________。(提示:查找四面体、八面体时,需假设Cu原子与Au原子等同;每个四面体、八面体内只填充一个氢原子)
-
(10分)铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为___________;
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是_______;
(3)SO42-的立体构型是________,其中S原子的杂化轨道类型是_______;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为__________。
-
铜(Cu)是重要金属,铜的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)向CuSO4浓溶液中滴入浓氨水,直至产生的沉淀恰好溶解,可得到深蓝色的透明溶液。再向其中加入适量乙醇,可析出深蓝色的Cu(NH3)4SO4•H2O晶体。
①沉淀溶解的离子方程式为_______________________________________________。
②[Cu(NH3)4]2+具有对称的立体构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的立体构型为_________________(用文字表述),其中N原子的杂化轨道类型是________。
(2)金(Au)与铜为同族元素,铜与金可形成具有储氢功能的合金。
①合金中,原子间的作用力是_______________。已知Au为第六周期元素,则基态Au原子的价电子排布式为________。
②该储氢合金为立方最密堆积结构,晶胞中Cu原子位于面心、Au原子位于顶点,储氢时,H原子进入由Cu原子与Au原子构成的四面体空隙中,则该晶体储氢后的化学式为_______________。
-
铜(Cu)是一种重要的常见金属,现代电子器件的电路离不开它,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答下列问题:
(1) 向CuSO4溶液里逐滴加入氨水,首先生成蓝色难溶物,然后得到深蓝色溶液。由蓝色难溶物得到深蓝色溶液的离子方程式为__________________ ;写出该深蓝色离子能反映出特殊共价键的结构简式________________;
(2) 元素金(Au)处于周期表中的第六周期,与Cu同族。一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心、Au原子处于顶角位置,则该合金中Cu原子与Au原子数量之比为________;该晶体中,原子之间的作用力是________________________;
(3) 上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的最简化学式应为________。
-
铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为________________________________________________________________________。
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是________________________________________________________________________。
(3)SO 中S以sp3杂化,SO
中S以sp3杂化,SO 的立体构型是________。
的立体构型是________。
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,金原子最外层电子排布式为____________。一种铜合金晶体具有立方最密堆积的结构,在晶胞中铜原子处于面心,金原子处于顶点位置,则该合金中铜原子与金原子数量之比为________;该晶体中,原子之间的作用力是________________________________________________________________________。
(5)CuSO4晶体的构成微粒是________和________,微粒间的作用力是________,该晶体属于________晶体。
(6)上述晶体具有储氢功能,氢原子可进入到由铜原子与金原子构成的四面体空隙中。若将铜原子与金原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式应为________。
-
铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为___________;
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是_______;
(3)SO42-的立体构型是________,其中S原子的杂化轨道类型是_______;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为__________。
-
I.下列分子中,属于非极性分子的是______
A、SO2 B、BeCl2 C、BBr3 D、COCl2
II.铜(Cu)是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.请回答以下问题:
(1)Cu+基态核外电子排布式为______.
(2)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为:______ CuSO4+SO2↑+2H2O
-
I.下列分子中,属于非极性分子的是 ________
A、SO2 B、BeCl2 C、BBr3 D、COCl2
II. 铜(Cu)是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)Cu+基态核外电子排布式为_______________ 。
(2)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为:______________ ___;
CuSO4粉末常用来检验一些有机物中的微量水分,其原因是______________________ _;
(3)SO42-的立体构型是__________,其中S原子的杂化轨道类型是____________;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,粒子之间的作用力是__________;
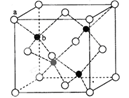
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm.密度为________(列式并计算)
-
Cu及其化合物在科学研究和工业生产中具有许多用途。请回答以下问题:
(1)向CuSO4浓溶液中滴加氨水至深蓝色的透明溶液.再向其中加入适量乙醇,发生的离子反应方程式__________________________;
(2)硫酸铜溶液中滴入氨基乙酸钠(H2N—CH2COONa)即可得到配合物A,其结构如图:
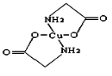
①SO42-中S原子的轨道杂化类型是________________;
②A中碳原子的轨道杂化类型为________________;
③1mol氨基乙酸钠含有δ键的数目为_________。
(3)元素金(Au)处于周期表中的第六周期,与Cu同族。一种铜合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,该合金中每一层均为_________(填“密置层”、“非密置层”);该晶体中,原子之间的作用力是_________。
(4)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的晶胞结构结构相似,该晶体储氢后的化学式应为_________,若Cu原子与Au原子的距离为a cm,则该晶体储氢后的密度为_________。(含a的表达式)


