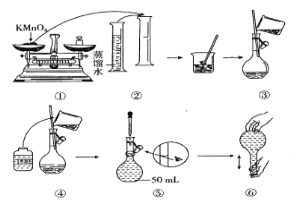
-
我国明代《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”。这里用到的实验方法可用于分离( )
A. 苯和水 B. 乙酸乙酯和乙酸
C. 食盐水和泥沙 D. 硝酸钾和硫酸钠
难度: 简单查看答案及解析
-
下列化学用语正确的是
A. 硫原子结构示意图:
B. 乙烯分子的结构简式:CH2CH2
C. H2O2的电子式:
D. 碳酸氢钠的电离方程式NaHCO3=Na++HCO3—
难度: 中等查看答案及解析
-
下列有关说法错误的是
A. 22. 4L氯气与足量铁反应一定转移2mol电子
B. 1mol氯气通入水中转移电子小于1mol
C. 1mol氯气通入足量NaOH溶液中转移电子可能等于1mol
D. 浓盐酸与氯酸钾反应生成3mol氯气转移5mol电子
难度: 中等查看答案及解析
-
下列有关金属的说法错误
A. 氧化膜使得性质活波的金属铝成为一种应用广泛的金属材料
B. 钛被称为继铁、铝之后的第三金属,也有人说“21世纪将是钛的世纪”
C. 在合金中加入适量稀土金属,能大大改善合金的性能。因此,稀土元素又被称为冶金工业的维生素
D. 出土的古代铜制品往往覆盖着一层铜绿,主要成分是CuCO3
难度: 中等查看答案及解析
-
半导体工业中,有一句行话:“从沙滩到用户”,即由SiO2制Si。制取过程中不涉及到的化学反应是
A. SiO2+2C
Si+2CO
B. SiO2+2NaOH=Na2SiO3
C. Si+2Cl2
SiCl4
D. SiCl4+2H2
Si+4HCl
难度: 中等查看答案及解析
-
下列四个选项中的两个反应可用同一个离子方程式表示的是
选项
Ⅰ
Ⅱ
A.
将少量SO2通入Ba(OH)2溶液
将过量SO2通入Ba(OH)2溶液
B.
将少量浓氨水滴入Al2(SO4)3溶液
将少量Al2(SO4)3溶液滴入浓氨水
C.
将0.1 mol Cl2通入含 0.2 mol FeBr2的溶液
将0.3 mol Cl2通入含0.2 mol FeBr2的溶液
D.
将少量BaCl2溶液与 Na2SO4 溶液相混合
将少量Ba(OH)2溶液与MgSO4溶液相混合
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知X、Y、Z、E、F五种常见物质含有同一元素M,在一定条件下它们有如下转化,Z是NO,下列推 断不合理的是

A. X可能是一种氢化物 B. X生成Z-定是化合反应
C. E可能是一种有色气体 D. F中M元素的化合价可能为+5
难度: 困难查看答案及解析
-
下列反应原子利用率最高的是
A. 工业制漂白粉2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
B. 工业制备钠2NaCl(熔融)
2Na+Cl2↑
C. 火法炼铜3Cu2S+3O2
6Cu+3SO2
D. 现代石油工业采用银做催化剂生产环氧乙烷2CH2=CH2→
难度: 中等查看答案及解析
-
向含1mol HCl和1mol MgSO4的混合溶液中加入1mol·L—1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是( )
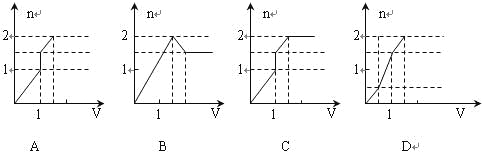
难度: 简单查看答案及解析
-
下列各组离子在水溶液中能大量共存的是
(1)I—、ClO—、NO3—、H+(2)K+、NH4+、HCO3—、OH-
(3)SO32—、SO42—、Cl-、OH—(4)Fe3+、Cu2+、SO42—、Cl-
(5)H+、K+、AlO2—、HSO3+(6)Ca2+、Na+、SO42—、CO32—
A. (1)和(6) B. (3)和(4) C. (2)和(5) D. (1)和(4)
难度: 中等查看答案及解析
-
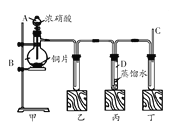
完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
选项
A
B
C
D
实验
用CCl4提取溴水中的Br2
除去乙醇中的苯
从KI和I2的固体混合物中回收I2
配制100 mL 0.1000mol·L−1 K2Cr2O7溶液
装置或仪器
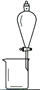

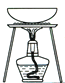

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
Cl2通入FeBr2和Fel2的混合溶液中,下列离子方程式一定错误的是
A. 2I-+Cl2=I2+2Cl-
B. 2I-+2Cl2+2Fe2+=I2+4Cl-+2Fe3+
C. 2I-+2Cl2+2Br-=I2+4Cl-+Br2
D. 2I-+3Cl2+2Br-+2Fe2+=I2+6Cl-+Br2+2Fe3+
难度: 困难查看答案及解析
-
在酸性高锰酸钾溶液中加入过氧化钠粉末,高锰酸钾溶液褪色。其中发生反应的离子方程式为:2MnO4—+16H++5Na2O2=2Mn2++5O2↑+8H2O+10Na+,下列判断正确是
A. 高锰酸钾是氧化剂,Na2O2既是氧化剂,又是还原剂
B. 反应的氧化产物只有氧气
C. 向高锰酸钾溶液中滴加浓盐酸可以得到酸性高锰酸钾溶液
D. 当反应产生标准状况下22.4 L氧气时,反应转移的电子为4 mol
难度: 中等查看答案及解析
-
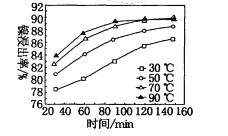
下图是氧气氧化某浓度Fe2+为Fe3+过程的实验结果,下列有关说法正确的是
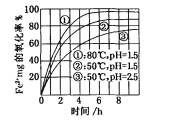
A. pH=1.5时氧化率一定比pH=2.5时大
B. 其他条件相同时,80℃的氧化率比50℃大
C. Fe2+的氧化率仅与溶液的pH和温度有关
D. 该氧化过程的离子方程式为:Fe2++O2+4H+=Fe3++2H2O
难度: 困难查看答案及解析