-
(1)湿法制各高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:______________________________
②每生成l mol FeO42-转移__________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为____mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4)原因是__。
(2)工业上从海水中提取单质溴可采用如下方法:
①向海水中通入Cl2将海水中溴化物氧化,其离子方程式为____。
②向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,其化学方程式为__。
③将②所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用有机溶剂提取溴后,还可得到副产品Na2SO4。这一过程可用化学方程式表示为____。
高三化学综合题中等难度题查看答案及解析
-
(1)湿法制各高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:______________________________
②每生成l mol FeO42-转移__________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为____mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4)原因是__。
(2)工业上从海水中提取单质溴可采用如下方法:
①向海水中通入Cl2将海水中溴化物氧化,其离子方程式为____。
②向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,其化学方程式为__。
③将②所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用有机溶剂提取溴后,还可得到副产品Na2SO4。这一过程可用化学方程式表示为____。
高三化学综合题中等难度题查看答案及解析
-
(1)湿法制各高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:______________________________
②每生成l mol FeO42-转移__________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为____mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4)原因是__。
(2)工业上从海水中提取单质溴可采用如下方法:
①向海水中通入Cl2将海水中溴化物氧化,其离子方程式为____。
②向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,其化学方程式为__。
③将②所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用有机溶剂提取溴后,还可得到副产品Na2SO4。这一过程可用化学方程式表示为____。
高三化学综合题中等难度题查看答案及解析
-
(1)湿法制各高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:______________________________
②每生成l mol FeO42-转移__________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为____mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4)原因是__。
(2)工业上从海水中提取单质溴可采用如下方法:
①向海水中通入Cl2将海水中溴化物氧化,其离子方程式为____。
②向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,其化学方程式为__。
③将②所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用有机溶剂提取溴后,还可得到副产品Na2SO4。这一过程可用化学方程式表示为____。
高三化学综合题中等难度题查看答案及解析
-
(1)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:________________________。
②每生成1 mol FeO42-转移________ mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________ mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),原因是________________________________________________________________。
(2)地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的化学方程式为[用Fe和HNO3(稀)反应表示]______________________________________。

高三化学解答题中等难度题查看答案及解析
-
(16分)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)请完成FeO42-与水反应的方程式:4FeO42-+10H2O
4Fe(OH)3+8OH-+_____。
K2FeO4在处理水的过程中所起的作用是 ________和 ________。
(2)常温下,Fe(OH)3 的Ksp = 4.0×10-38 ,请写出Fe(OH)3在水中的溶解平衡方程式 ________
(3)将适量K2FeO4配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。第(1)题中的反应为FeO42-变化的主反应,则温度对该反应的反应速率和平衡移动的影响是________ ;发生反应的△H ________ 0(填“>”、“<”或“=”)。
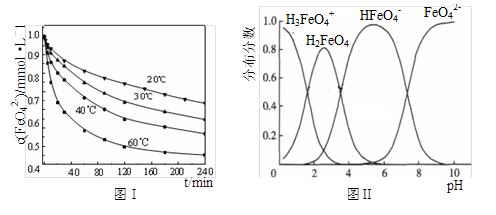
(4)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是________(填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:
H2FeO4+OH-=HFeO4-+H2O
高三化学填空题中等难度题查看答案及解析
-
高铁酸钾(K2FeO4)是一种常用的水处理剂。工业制备高铁酸钾的离子方程式为:3C1O-+10OH-+2Fe3+═2FeO42-+3C1-+5H2O。下列相关叙述不合理的是( )
A.K2FeO4中铁元素的化合价是+6
B.制得1molK2FeO4转移3mole-
C.Fe3+的氧化性强于FeO42-的氧化性
D.氧化产物和还原产物物质的量之比为2:3
高三化学单选题中等难度题查看答案及解析
-
(15分)高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
(1)已知:4FeO42-+10H2O
4Fe(OH) 3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH= 的溶液。
(2)高铁酸钾有以下几种常见制备方法:
干法
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物
湿法
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液
电解法
制备中间产物Na2FeO4,再与KOH溶液反应
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为____ 。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:____ ________________。
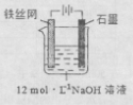
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应
式为 。
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:
3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH
放电时负极材料为____ ,正极反应为:____ 。
(4) 25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000 L含有2.0×l0-4 mol·L-l K2FeO4的废水中的c(FeO42-)有沉淀产生,理论上至少加入Ca(OH)2的物质的量为____ mol。
高三化学填空题困难题查看答案及解析
-
高铁酸钾是一种理想的绿色水处理剂,工业上可通过如下反应制得:Fe(OH)3+ClO-+OH-一FeO42-+Cl-+H2O(未配平),在上述反应中( )
A.FeO4 2-是还原产物
B.ClO-是还原剂
C.1molFe(OH)3得到3mol电子
D.配平后OH-的化学计量数为4高三化学选择题中等难度题查看答案及解析
-
高铁酸钾(
K2FeO4)是一种比Cl2
、O3、KMnO4氧化性更强的多功能水处理剂.工业上可先制得高铁酸钠(离子反应为2Fe(OH)3+3ClO﹣+4OH﹣═2Fe
O42-+3Cl﹣+5H2O,然后在高铁酸钠溶液中加入一定量的KOH,可析出高铁酸钾.下列说法不正确的是( )
A.高铁酸钾的还原产
物易水解形成胶体,可使水中悬浮物凝聚沉降
B.工业上制备高铁酸钠时每生成1mol还原产物,转移3mol电子
C.高铁酸钾中Fe为+6价,具有强氧化性,能消毒杀菌
D.高铁酸钾能除去水中溶解的H2S等
高三化学选择题困难题查看答案及解析