-
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性,已知:4FeO42﹣+10H2O⇌4Fe(OH)3+8OH﹣+3O2↑高铁酸钾常见制备方法之一是湿法制备:在一定条件下,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液.下列说法正确的是( )
A. K2FeO4在处理水的过程中所起的作用只有消毒杀菌
B. 同浓度的高铁酸钾在pH=ll.50的水溶液中比中性溶液中稳定
C. 湿法制备高铁酸钾,可以在酸性环境中顺利进行
D. 湿法制备高铁酸钾,Fe(NO3)3与NaClO物质的量之比为3:2
-
(15分)高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
(1)已知:4FeO42-+10H2O  4Fe(OH) 3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
4Fe(OH) 3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH= 的溶液。
(2)高铁酸钾有以下几种常见制备方法:
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 | 制备中间产物Na2FeO4,再与KOH溶液反应 |
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为____ 。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:____ ________________。
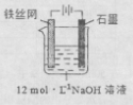
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应
式为 。
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时负极材料为____ ,正极反应为:____ 。
(4) 25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000 L含有2.0×l0-4 mol·L-l K2FeO4的废水中的c(FeO42-)有沉淀产生,理论上至少加入Ca(OH)2的物质的量为____ mol。
-
高铁酸钾(K2FeO4)具有强氧化性,是一种新型多功能水处理剂,其生产工艺流程如下:
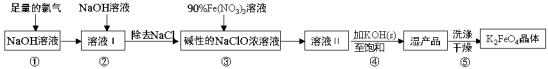
已知:K2FeO4在水溶液中易发生反应: 4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑,下列说法不正确的是
4Fe(OH)3+8OH-+3O2↑,下列说法不正确的是
A.步骤③中氧化剂与还原剂的物质的量之比为3:2
B.步骤④中Na2FeO4转变为湿产品是因为K2FeO4溶解度更小
C.步骤⑤中的洗涤剂可用CH3COOK和异丙醇来配制
D.配制90%Fe(NO3)3溶液必需的玻璃仪器有容量瓶、烧杯、量筒、玻璃棒
-
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是4FeO42-+10H2O===4Fe(OH)3(胶体)+3O2↑+8OH-,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备:2Fe(OH)3+3ClO-+4OH-===2FeO42-+3Cl-+5H2O;
干法制备:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列有关说法中错误的是( )
A.高铁酸钾与水反应时,水发生氧化反应
B.干法中每生成1 mol Na2FeO4共转移4 mol电子
C.湿法中每生成1 mol Na2FeO4共转移3 mol电子
D.K2FeO4处理水时,不仅能杀菌,并使悬浮杂质沉降
-
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是:
4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-
工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备——2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
干法制备——2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列有关说法中错误的是( )
A.高铁酸钾与水反应时,水发生氧化反应
B.干法中每生成1mol Na2FeO4共转移4mol电子
C.湿法中每生成1mol Na2FeO4共转移3mol电子
D.K2FeO4处理水时,不仅能杀菌,还能除去H2S、NH3等,并使悬浮杂质沉降
-
高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂.
(1)已知:4FeO42-+10H2O⇌4Fe(OH)3+8OH-+3O2.K2FeO4在处理水的过程中所起的作用有______、______.
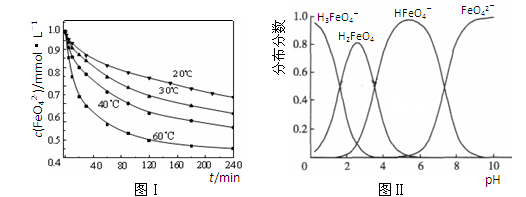
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0mmol•L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ.该实验的目的是______;发生反应的△H______0(填“>”、“<”或“=”).
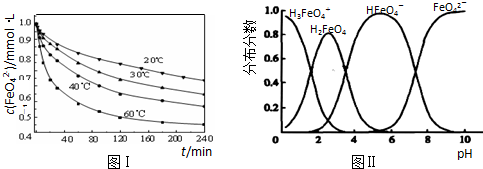
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示.下列说法正确的是______(填字母).
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O
(4)高铁酸钾还制作可充电电池,原理为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,写出该电池充电时阳极电极反应式______.
3Zn(OH)2+2Fe(OH)3+4KOH,写出该电池充电时阳极电极反应式______.
-
(13分)材料1:铁及其化合物在工农业、生活中有广泛的应用。高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有________。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是________;发生反应的△H ________0(填“>”、“<”或“=”)。
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是________(填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
材料2:化合物KxFe(C2O4) y·zH2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成。
I.制备:

(4)结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是。
(5)操作Ⅲ的名称是________。
Ⅱ.组成测定:
称取0.491g实验所得晶体(假设是纯净物)置于锥形瓶中,加足量蒸馏水和稀H2SO4。将C2O42-完全转化为H2C2O4,用0.10mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液12.00mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液2.00mL。相关反应如下:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(6)配制250mL 0.10mol·L-1KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有________和________。两个滴定中到达终点时溶液颜色为________色,且30秒内不变色。
(7)通过计算,求此光敏材料的化学式。
-
(13分)材料1:铁及其化合物在工农业、生活中有广泛的应用。高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有________。
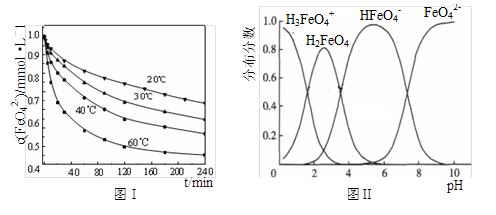
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是________;发生反应的△H ________0(填“>”、“<”或“=”)。
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是________(填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
材料2:化合物KxFe(C2O4) y·zH2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成。
I.制备:

(4)结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是。
(5)操作Ⅲ的名称是________。
Ⅱ.组成测定:
称取0.491g实验所得晶体(假设是纯净物)置于锥形瓶中,加足量蒸馏水和稀H2SO4。将C2O42-完全转化为H2C2O4,用0.10mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液12.00mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液2.00mL。相关反应如下:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(6)配制250mL 0.10mol·L-1KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有________和________。两个滴定中到达终点时溶液颜色为________色,且30秒内不变色。
(7)通过计算,求此光敏材料的化学式。
-
(16分)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)请完成FeO42-与水反应的方程式:4FeO42-+10H2O 4Fe(OH)3+8OH-+_____。
4Fe(OH)3+8OH-+_____。
K2FeO4在处理水的过程中所起的作用是 ________和 ________。
(2)常温下,Fe(OH)3 的Ksp = 4.0×10-38 ,请写出Fe(OH)3在水中的溶解平衡方程式 ________
(3)将适量K2FeO4配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。第(1)题中的反应为FeO42-变化的主反应,则温度对该反应的反应速率和平衡移动的影响是________ ;发生反应的△H ________ 0(填“>”、“<”或“=”)。
(4)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是________(填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:
H2FeO4+OH-=HFeO4-+H2O
-
高铁酸钾 (K2FeO4)是一种优良的水处理剂,将其溶于水中缓慢发生发应 4FeO42-+10H2O 4Fe (OH)3+8OH -+3O2↑。在 pH=4.7 的溶液中,配成 c (K2FeO4)=1.0×10-3mol·L-1 试样,分别置于 20-60℃的恒 温水浴中,测定 K2FeO4 总量的变化如图,纵坐标为试样的浓度, 则下列说法不正确的是
4Fe (OH)3+8OH -+3O2↑。在 pH=4.7 的溶液中,配成 c (K2FeO4)=1.0×10-3mol·L-1 试样,分别置于 20-60℃的恒 温水浴中,测定 K2FeO4 总量的变化如图,纵坐标为试样的浓度, 则下列说法不正确的是
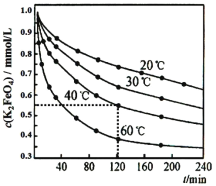
A.试样溶液的酸性越强,K2FeO4 越不稳定
B.40℃时,在 0~120 min 内,K2FeO4 的分解速率为3.75×10-3 mol·Lˉ1·minˉ1
C.由图可知,反应体系温度越高,分解速率越快
D.当分解足够长时间后,四份试样的分解率相等
4Fe(OH) 3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。

3Zn(OH)2+2Fe(OH)3+4KOH







