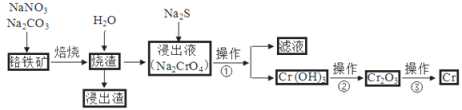
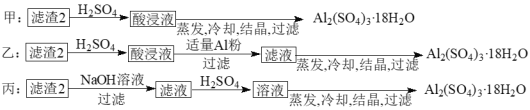
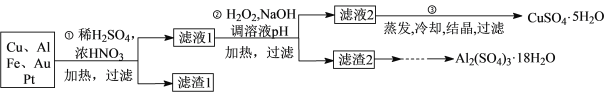-
下列说法正确的是
A. 等质量的铝分别与足量Fe2O3或Fe3O4发生铝热反应时,转移电子的数目相等
B. 质量分数分别为40%和60%的硫酸溶液等体积混合,所得溶液的质量分数为50%
C. 金属钠着火时,立即用泡沫灭火器灭火
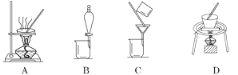
D. 洗涤做焰色反应的铂丝,可选用稀盐酸或稀硫酸
难度: 中等查看答案及解析
-
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入到FeCl3溶液中 ②过量NaOH溶液和明矾溶液混合 ③少量Ca(OH)2投入到过量NaHCO3溶液中 ④向NaAlO2溶液中滴入少量盐酸 ⑤向饱和Na2CO3溶液中通入足量CO2
A. ①③④⑤ B. 只有①④ C. 只有②③ D. 只有③④⑤
难度: 中等查看答案及解析
-
SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O===SO42-+2Fe 2++4H+;
②Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O。
下列有关说法不正确的是
A. SO2发生氧化反应
B. 氧化性:SO42- < Fe3+ < Cr2O72-
C. 每0.2 mol K2Cr2O7参加反应,转移电子的数目为1.2NA
D. 若有13.44 L SO2(标准状况)参加反应,则最终消耗0.4mol K2Cr2O7
难度: 中等查看答案及解析
-
化学与生活密切相关,下列说法错误的是
A. 明矾可用作净水剂
B. 纯碱可用于中和过多的胃酸
C. 硫酸铜常用作游泳馆池水消毒剂
D. 硫酸钡可用于胃肠X射线造影检查
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数值,下列说法正确的是
A. 2 mL 0.5 mol/L FeCl3溶液滴入沸水中制备Fe(OH)3胶体,所得胶粒数目为0.001NA
B. 标准状况下,3.36LSO3含有的电子数为6NA
C. 铁和水蒸气反应生成22.4L氢气,转移电子数为2NA
D. 将含有3NA个离子的过氧化钠固体溶于水配成1L溶液,所得溶液中Na+的浓度为 2mol/L
难度: 中等查看答案及解析
-
表示下列反应的离子方程式正确的是
A. 磁性氧化铁溶于稀硝酸:3Fe2++4H++ NO 3-
3Fe3++NO↑+3H2O
B. 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-
Mn2++Cl2↑+2H2O
C. 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O
Al(OH)3↓+HCO3-
D. 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3
2FeO42-+3Cl-+H2O+4H+
难度: 中等查看答案及解析
-
下列金属冶炼的反应原理,错误的是
A. 2NaCl(熔融)
2Na+Cl2↑ B. Al2O3+3H2
2Al+3H2O
C. Fe3O4+4CO
3Fe+4CO2 D. 2HgO
2Hg+O2↑
难度: 简单查看答案及解析
-
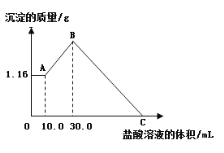
向100mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液逐滴加入0.2mol·L−1的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示。下列判断正确的是( )
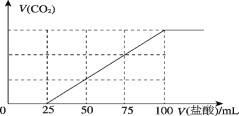
A. 原NaOH溶液的浓度为0.1mol·L−1
B. 通入CO2的体积为448mL
C. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=2∶1
D. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
难度: 困难查看答案及解析
-
甲、乙两烧杯中各盛有100 mL 3 mol/L的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉质量为( )
A. 2.7 g B. 3.6 g C. 5.4 g D. 1.8 g
难度: 中等查看答案及解析
-
取少量MgO、Al2O3、SiO2、Fe2O3的混合粉末,加入过量盐酸,充分反应后过滤,得到沉淀X和滤液Y。下列叙述中正确的是( )
A. 上述四种氧化物对应的水化物中,Al(OH)3酸性最强
B. 向沉淀X中加入氢氟酸,沉淀X不溶解
C. 溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
D. 溶液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2
难度: 中等查看答案及解析
-
用NaCl 固体配制0.1mo/L 的NaCl 溶液1000mL,下列操作或说法正确的是( )
A. 将5.85gNaCl 固体溶于1L水中可配成0.1mol/L的NaCl 溶液
B. 称量时,将固体NaCl 直接放在天平左盘上
C. 固体溶解后,将溶液转移到容量瓶中,然后向容量瓶中直接加水稀释到刻度线
D. 配制溶液时容量瓶中原来有少量蒸馏水不会影响实验结果
难度: 中等查看答案及解析
-
已知:SO2+2H2O+I2=H2SO4+2HI; 向含SO32-、Fe2+、Br-、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是
A.
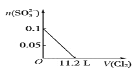 B.
B. 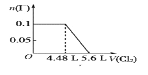 C.
C. 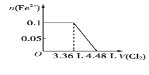 D.
D. 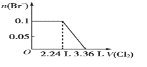
难度: 困难查看答案及解析
-
下列说法正确的有
①1 mol FeI2与足量氯气反应时转移的电子数为2NA
②Na2O2分别与水及CO2反应产生等量氧气时,消耗水和CO2的物质的量相等
③无色溶液中可能大量存在Al3+、NH4+、Cl-、S2-
④Na2O2投入紫色石蕊试液中,溶液先变蓝,后褪色
⑤2 L 0.5 mol·L-1硫酸钾溶液中阴离子所带电荷数为NA
⑥在漂白粉的溶液中通入少量二氧化硫气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO
A. 1 B. 2 C. 3 D. 4
难度: 中等查看答案及解析
-
工业上用盐酸酸化的FeCl3溶液腐蚀铜制线路板,分别取腐蚀后的滤液并向其中加入下列指定物质,反应后的溶液中主要存在的-组离子正确的是( )
A. 加入过量CuO:Fe3+、H+、Cu2+、Cl-
B. 加入过量NaOH溶液: Na+、Fe2+、 OH-、Cl-
C. 通入过量Cl2: Fe3+、H+、Cu2+、Cl-
D. 通入过量SO2: Fe3+、H+、Cu2+、SO42-、Cl-
难度: 简单查看答案及解析
-
标准状况下有①0.112 L 水;②3.01×1023 个氯化氢分子;③13.6 g H2S 气体;④0.2 mol NH3,下列对这 四种物质的关系由小到大排列正确的是
A. 体积:①③②④ B. 密度:④①③②
C. 质量:①④③② D. 氢原子数:②④③①
难度: 中等查看答案及解析
-
某100 mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是
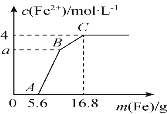
A. 原溶液的c(H+)=4 mol·L-1
B. 若a=3,则原溶液中c(Cu2+)=1 mol·L-1
C. 原溶液中的c(NO3-)=7 mol·L-1
D. BC段发生反应的离子方程式为Cu2++Fe
Fe2++Cu
难度: 困难查看答案及解析