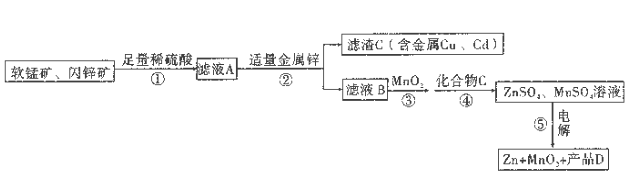
-
化学与生活、科技关系密切。下列有关叙述正确的是
A. 液氨可用作制冷剂是因为其汽化时可放出大量的热
B. 二氧化硅可制玻璃、单质硅、光导纤维
C. 钢制品、铝制品在日常生活中被广泛应用是因为铁、铝为活泼金属
D. 久置的漂白粉变质是因为漂白粉与空气中的O2反应
难度: 中等查看答案及解析
-
中国丝绸有五千年的历史和文化。古代染坊常用某种“碱剂”来精炼丝绸,该“碱剂”的主要成分是一种盐, 能促进蚕丝表层的丝胶蛋白杂质水解而除去,使丝绸颜色洁白、质感柔软、色泽光亮这种“碱剂”可能是
A. 草木灰 B. 火碱 C. 食盐 D. 胆矾
难度: 中等查看答案及解析
-
“神舟十号”的运载火箭所用燃料是偏二甲肼(C2H8N2 )( 其中N 的化合价为-3 )和四氧化二氮(N2O4)。在火箭升空过程中,燃料发生反应: C2H8N2 +2N2O4→2CO2+3N2+4H2O 提供能量。下列有关叙述正确的是
A. 该燃料无毒,在燃烧过程中不会造成任何环境污染
B. 每有0.6molN2生成,转移电子数目为2.4NA
C. 该反应中N2O4是氧化剂,偏二甲肼是还原剂
D. N2既是氧化产物又是还原产物,CO2既不是氧化产物也不是还原产物
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述中一定正确的是
A. 1molFe与高温水蒸气反应,转移电子的数目为3NA
B. 标准状况下,2.24 LHF 中含有的极性键数目为0.1NA
C. 5mL0.1mol/LCH3COOH 溶液和10mL0.5mol/LCH3COOH 溶液中所含CH3COOH 分子数相等
D. 一定条件下,向0.1L容器内通入4.6gNO2气体,NO2的物质的量浓度小于1mol/L
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 使酚酞变红色的溶液中:Na+、Cu2+、HCO3-、NO3-
B.
=1x 10-13mol/L的溶液中:NH4+、Ca2+、Cl-、NO3-
C. 与Al 反应能放出H2的溶液中: Fe3+、K+、NO3- 、SO42-
D. 0.1mol/LNaAlO2溶液:H+、Na+、Cl-、SO42-、
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A. 铜溶于0.5mo/L 的硝酸: Cu+4H++2NO3- =Cu2++2NO2 ↑+2H2O
B. Na2S2O3溶液中加入稀硫酸: 2S2O32-+ 4H+ =SO42-+ 3S ↓+ 2H2O
C. 向Ba(OH)2溶液中加入少量的NH4HSO4溶液: Ba2++OH-+H++SO42-=BaSO4↓+H2O
D. Ca(HCO3)2溶液与少量NaOH 溶液反应: HCO3-+Ca2+ +OH-=CaCO3↓+H2O
难度: 中等查看答案及解析
-
实验:①0.1mol•L﹣1AgNO3溶液和0.1mol•L﹣1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加0.1mol•L﹣1KI溶液,出现浑浊;
③向沉淀c中滴加0.1mol•L﹣1KI溶液,沉淀变为黄色.
下列分析不正确的是( )
A. 浊液a中存在沉淀溶解平衡:AgCl(s)
Ag+(aq)+Cl﹣(aq)
B. 滤液b中不含有Ag+
C. ③中颜色变化说明AgCl转化为AgI
D. 实验可以证明AgI比AgCl更难溶
难度: 中等查看答案及解析
-
下列有关实验现象和解释或结论都正确的选项是
选项
实验操作
现象
解释或结论
A
把SO2通入紫色石蕊试液中
紫色褪去
SO2具有漂白性
B
把浓硫酸滴到pH 试纸上
试纸变红
浓硫酸具有酸性
C
将充满NO2的密闭玻璃球浸泡在热水中
红棕色变浅
反应2NO2
N2O4的Δ H<0
D
将硫的酒精溶液滴入一定量的热水中得淡蓝色透明液体,用激光笔照射
有丁达尔效应
淡蓝色液体为胶体
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
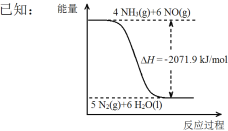
已知下列反应的热化学方程式
6C(s)+5H2(g)+3N2(g)+9O2(g) 2C3H5(ONO2)3(l) ΔH1
2 H2(g)+ O2(g) 2H2O(g) ΔH2
C(s)+ O2(g) CO2(g) ΔH3
则反应4C3H5(ONO2)3(l) 12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为
A. 12ΔH3+5ΔH2-2ΔH1 B. 2ΔH1-5ΔH2-12ΔH3
C. 12ΔH3-5ΔH2-2ΔH1 D. ΔH1-5ΔH2-12ΔH3
难度: 困难查看答案及解析
-
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )
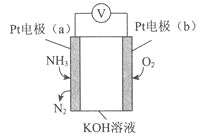
A. 溶液中OH-向电极a移动
B. O2在电极b上发生还原反应
C. 反应消耗的NH3与O2的物质的量之比为4:5
D. 电极a的反应式为2NH3-6e-+6OH-=N2+6H2O
难度: 中等查看答案及解析
-
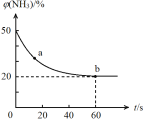
T℃时,反应物和生成物均为气体的某反应,反应过程中浓度变化如图(Ⅰ)所示。若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
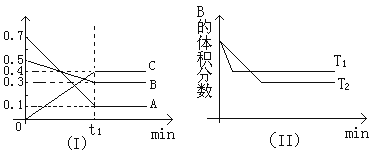
A.在t1时间内用B表示该反应的平均速率为:0.6mol·L-1·mim-1
B.在(t1+10)时,保持其他条件不变,增大压强,平衡向逆反应方向移动
C.T时,在相同容器中,若由0.1mol·L-1A、0.3mol·L-1B和0.4mol·L-1C反应,达到平衡后,C的浓度仍为0.4mol·L-1
D.在其他条件不变时,升高温度,正、逆反应速率均增大,且A的转化率增大
难度: 困难查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13。X的原子半径比Y的小,X 与W同主族,Z是地壳中含量最高的元素。下列说法正确的是
A. 原子半径的大小顺序:r(Y)>r(Z)>r(W)
B. 元素Z、W 的简单离子的电子层结构不同
C. 元素Y 的简单气态氢化物的热稳定性比Z 的强
D. 只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物
难度: 中等查看答案及解析
-
25℃时,在10mL浓度均为0.1mol/LNaOH和NH3•H2O混合溶液中,滴加0.1mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是( )
A. 未加盐酸时:c(OH-)>c(Na+)= c(NH3•H2O)
B. 加入10mL盐酸时:c(NH4+)+c(H+)=c(OH-)
C. 加入盐酸至溶液pH=7时:c(Cl-) = c(Na+)
D. 加入20mL盐酸时:c(Cl-)=c(NH4+)+c(Na+)
难度: 中等查看答案及解析
-
已知A、B为单质,C为化合物。
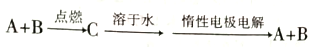
能实现上述转化关系的是
①若C溶于水后得到强碱溶液,则A 可能是Na
②若C的溶液遇Na2CO3, 放出CO2气体,则A 可能是H2
③若C的溶液中滴加KSCN 溶液显红色,则B可能为Fe
④若C 的溶液中滴加NaOH溶液有蓝色沉淀生成,则B 可能为Cu
A. ①② B. ②④ C. ①③ D. ③④
难度: 困难查看答案及解析
-
一定量的CuS 和Cu2S 的混合物投入足量的HNO3中,收集到气体VL (标准状况),向反应后的溶液中(存在Cu2+和SO42- )加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧、得到CuO 24.0g,若上述气体为NO 和NO2的混合物,且体积比为1:2。则V 可能为
A. 9.0 L B. 18.5L C. 25.7L D. 36.8L
难度: 困难查看答案及解析
-
以惰性电极电解CuSO4和NaCl 的混合溶液,两电极上产生的气体(标准状况下测定)体积如下图所示,下列有关说法正确的是
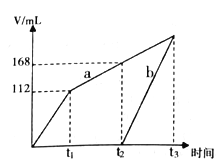
A. 原溶液中CuSO4和NaCl物质的量之比为1:1
B. a表示阴极上产生的气体,前产生的为Cl2
C. 若t1时溶液的体积为1L,此时溶液的pH 为13
D. 若原溶液体积为1L,则原溶液中SO42- 的物质的量浓度为0.2 mol/L
难度: 困难查看答案及解析