-
在下列能源中,属于二次能源的是
A. 风力 B. 原煤 C. 石油 D. 电力
难度: 简单查看答案及解析
-
下列对有关事实或解释不正确的是( )
编号
事实
解释
①
锌与稀硫酸反应,加入氯化钠固体,速率加快
增大了氯离子浓度,反应速率加快
②
锌与稀硫酸反应,滴入较多硫酸铜溶液,生成氢气的速率减慢
锌置换铜的反应干扰了锌置换氢的反应,致使生成氢气的速率变慢
③
5%的双氧水中加入二氧化锰粉末,分解速率迅速加快
降低了反应的焓变,活化分子数增多,有效碰撞增多,速率加快
④
面粉生产车间容易发生爆炸
固体表面积大,反应速率加快
A. ①④ B. ②③
C. ①②③ D. ①②④
难度: 中等查看答案及解析
-
硫代硫酸钠溶液与稀硫酸反应的化学方程式为: Na2S2O3+ H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
实验
反应温度/℃
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/(mol·L-1)
V/mL
c/(mol·)
V/mL
A
25
5
0.1
10
0.1
5
B
25
5
0.2
5
0.2
10
C
35
5
0.1
10
0.1
5
D
35
5
0.2
5
0.2
10
难度: 中等查看答案及解析
-
己知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示。下列说法正确的是
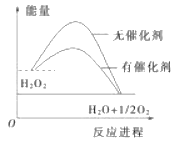
A. H2O2分解属于吸热反应
B. 加入催化剂,减小了反应的热效应
C. 加入催化剂,可提高正反应的活化能
D. 反应物的总能量高于生成物的总能量
难度: 简单查看答案及解析
-
已知在101KPa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A. H2O(g)=H2(g)+1/2O2;△H(298K)=-242kJ·mol-1
B. H2(g)+1/2O2(g)=H2O(1);△H(298K)=+484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g);△H(298K)=-242kJ·mol-1
D. H2(g)+1/2O2(g)=H2O(g);△H(298K)=-484kJ·mol-1
难度: 简单查看答案及解析
-
下列物质间的反应,其能量变化符合如图的是

A. 甲烷的燃烧 B. 灼热的炭与二氧化碳反应
C. Ba(OH)2·8H2O晶体和NH4Cl晶体混合 D. 碳酸钙的分解
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 任何化学反应都伴随能量变化
B. 化学反应中的能量变化都表现为热量的变化
C. 反应物的总能量高于生成物的总能量,则反应释放出能量
D. 反应物的总能量低于生成物的总能量,则反应吸收能量
难度: 简单查看答案及解析
-
下列关于热化学反应的描述中正确的是( )
A. 中和热ΔH=-57.3 kJ·mol-1,则浓H2SO4和Ba(OH)2反应的反应热为ΔH=-114.6kJ·mol-1
B. H2(g)的燃烧热是-285.8 kJ·mol-1,则2H2O(g)===2H2(g)+O2(g)反应的反应热ΔH=+2×285.8kJ·mol-1
C. 碳燃烧生成一氧化碳时,放出的热量为碳的标准燃烧热
D. 乙炔的标准燃烧热为1299.6 kJ·mol-1,则2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)反应的ΔH=-2599.2kJ·mol-1
难度: 中等查看答案及解析
-
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
难度: 中等查看答案及解析
-
反应3 H2+N2
2 NH3在密闭容器中进行。下列关于该反应的说法错误的是
A. 升高温度能加快反应速率 B. 使用恰当的催化剂能加快反应速率
C. 增大N2的浓度能加快反应速率 D. 平衡时各组分含量之比一定等于3:1:2
难度: 中等查看答案及解析
-
在恒温、恒容条件下,能使A(g)+B(g)⇌C(g)+D(s) 正反应速率增大的措施是
A. 减小C或D的浓度 B. 再加入一定量D
C. 减小B的浓度 D. 增大A或B的浓度
难度: 中等查看答案及解析
-
一定条件下,在恒容密闭容器中,能表示反应X(气)+2Y(气)
2Z(气)一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
A. ①② B. ①④ C. ②③ D. ③④
难度: 中等查看答案及解析
-
对于反应A(g)+3B(g)===4C(g)+2D(g),在相同时间内,用不同物质表示的平均反应速率如下,则反应速率最快的是( )
A.v(A)=0.4 mol/(L·s) B.v(B)=0.8 mol/(L·s)
C.v(C)=1.2 mol/(L·s) D.v(D)=0.7 mol/(L·s)
难度: 中等查看答案及解析
-
2 molA与2 molB混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g)
2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断不正确的是( )
A. z=2 B. 2s后,容器内的压强是初始的7/8倍
C. 2s时C的体积分数为2/7 D. 2s后,B的浓度为0.5mol/L
难度: 困难查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g),在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A. ①④ B. ②③ C. ①③ D. ②④
难度: 困难查看答案及解析
-
把 0.6molX气体和0.4molY气体混合于2L的密闭容器中,使它们发生如下反应 3X(g)+Y(g)
nZ(g)+2W(g),5min末已生成 0.2molW,若测知以 Z 表示的平均反应速率为 0.01mol•L﹣1•min﹣1,则 n是( )
A. 2 B. 4 C. 1 D. 3
难度: 中等查看答案及解析