-
研究化学反应的快慢和限度具有十分重要的意义。回答下列问题:
(1)反应2SO2(g) + O2(g) 2SO3(g)是制备硫酸的重要反应,该反应为放热反应。降低温度,逆反应的速率_________;使用催化剂V2O5,正反应的速率__________ (以上填“增加”、“不变”或“减小”)。
2SO3(g)是制备硫酸的重要反应,该反应为放热反应。降低温度,逆反应的速率_________;使用催化剂V2O5,正反应的速率__________ (以上填“增加”、“不变”或“减小”)。
(2)常温下,实验室用100 mL 6.0 mol·L-1硫酸跟足量锌粉反应制取氢气。
①为降低反应进行的速率,又不影响生成氢气的量,可向反应物中加入____(填序号 )。
A.CH3COONa固体 B.KNO3固体
C.K2SO4溶液 D.KHSO4溶液
②向溶液中滴加少量硫酸铜溶液,反应速率加快,原因是___________________。
(3)一定温度下,在体积固定的密闭容器中,有色气体N与无色气体M的物质的量随时间变化曲线如图所示。反应达平衡的时间是____________,该反应的化学方程式可表示为______________________________,
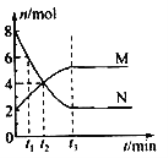
下列说法中能够判定该反应处于平衡状态的是______________(填 序号)
A.容器的压强不再变化 B.气体的颜色不再变化
C.每反应2 mol的N生成1 mol的M D.气体的密度不再发生变化
-
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义。
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关如图所示,根据如图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关如图所示,根据如图回答下列问题:
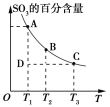
①2SO2(g)+O2(g) 2SO3(g)为__________反应(填“吸热”“放热”)。
2SO3(g)为__________反应(填“吸热”“放热”)。
②一定条件下,将SO2与O2以体积比为2︰1置于一体积不变的密闭容器中发生反应,能说明该反应已达到平衡的是________(填选项字母)。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量分数不再变化
d.单位时间内转移4 mol电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
③V2O5可作为2SO2(g)+O2(g) 2SO3(g)的催化剂,催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物;四价钒氧化物再被氧气氧化为V2O5。写也该催化循环机理的化学方程式__________,________。
2SO3(g)的催化剂,催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物;四价钒氧化物再被氧气氧化为V2O5。写也该催化循环机理的化学方程式__________,________。
(2)一定条件下,合成氨反应为:N2(g)+3H2(g) 2NH3(g)ΔH<0。图1表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线。图2表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)ΔH<0。图1表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线。图2表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
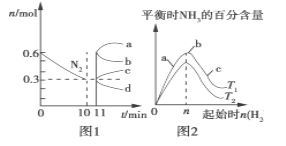
①由图1信息,从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为________(填“a”“b”“c”或“d”,下同);增加氮气的物质的量,则n(N2)的变化曲线为________。
②由图2信息,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是________点,T2____T1(填“>”“=”或“<”)。
-
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知反应:2SO2(g) + O2(g) 2SO3(g),反应速率v(SO2)=0.05mol·L-1·min-1,则v(O2) =___________ mol·L-1·min-1。
2SO3(g),反应速率v(SO2)=0.05mol·L-1·min-1,则v(O2) =___________ mol·L-1·min-1。
(2)已知:2SO2(g) + O2(g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) △H=-113.0 kJ·mol-1
2NO2(g) △H=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的 △H=___________kJ·mol-1。
SO3(g)+NO(g)的 △H=___________kJ·mol-1。
(3)一定温度下,将NO2与SO2以体积比1∶2 置于容积固定的密闭容器中发生(2)中反应,下列事实能说明反应达到化学平衡状态的是___________(填正确选项字母编号)。
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO2和SO2的体积比保持不变 d.△H保持不变
-
(11分)运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义。
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3 的百分含量和温度的关系如图所示,根据图回答下列问题:
2SO3(g),平衡混合体系中SO3 的百分含量和温度的关系如图所示,根据图回答下列问题:
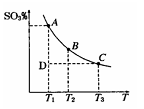
①2SO2(g)+O2(g) 2SO3(g)的△H________0(填“>”或“<”),
2SO3(g)的△H________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是________。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4 mol 电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
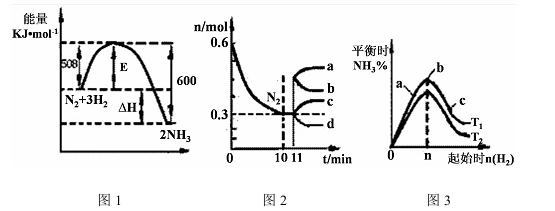
①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
-
(12分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为________。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH= —196.6 kJ·mol-1
2SO3(g) ΔH= —196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH= —113.0 kJ·mol-1
2NO2(g) ΔH= —113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=________kJ·mol-1
SO3(g)+NO(g)的ΔH=________kJ·mol-1
一定条件下,将1 mol NO2与2 mol SO2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2物质的量之比为1:6,则平衡常数K=________。

(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH________0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH________0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________。
-
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为_____________________
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6kJ·mol-1
2SO3(g) ΔH=-196.6kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)  SO3(g)+NO(g) 的ΔH=________kJ·mol-1
SO3(g)+NO(g) 的ΔH=________kJ·mol-1
(3)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________ (保留两位小数)
(4)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)  CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是____________________
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是____________________

-
运用化学反应原理研究化学反应有着非常重要的意义。
(一)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
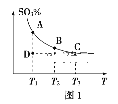
①2SO2(g)+O2(g) 2SO3(g)的ΔH___0(填“>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡___移动(填“向左”“向右”或“不”)。
2SO3(g)的ΔH___0(填“>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡___移动(填“向左”“向右”或“不”)。
②若反应进行到状态D时,v(正)___v(逆)(填“>”“<”或“=”)。
(二)工业上合成氨技术叫哈伯法:N2(g)+3H2(g) 2NH3(g) ΔH<0,此法达到平衡时反应物的转化率不高。
2NH3(g) ΔH<0,此法达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是___(填编号)。
A.使用更高效的催化剂
B.升高温度
C.及时分离出氨气
D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=__。

从11min起,压缩容器的体积为1L,则n(N2)的变化曲线为___(填编号)。
A.a B.b C.c D.d
-
运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)  2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
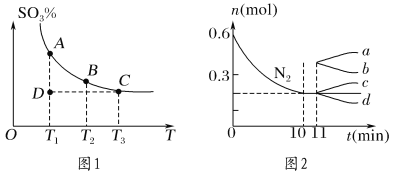
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________(填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,v逆 ________ (填“>”“<”或“=”)v正。
(2)课本里介绍的合成氨技术叫哈伯法:N2(g)+3H2(g)  2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是________(填编号)。
A.使用更高效的催化剂 B.增大压强
C.及时分离出氨气 D.升高温度
②若在某温度下,2 L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用NH3表示0~10 min内该反应的平均速率v(NH3)=______________;从第11 min起,升高温度,则n(N2)的变化曲线为________(填编号)。
-
运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
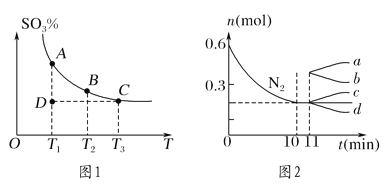
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________(填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,v正________(填“>”“<”或“=”)v逆。
(2)课本里介绍的合成氨技术叫哈伯法:N2(g)+3H2(g) 2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是________(填编号)。
A.使用更高效的催化剂
B.升高温度
C.及时分离出氨气
D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2 L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10 min内该反应的平均速率v(H2)=________。从第11 min起,压缩容器的体积为1 L,则n(N2)的变化曲线为________(填编号)。
-
(10分)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
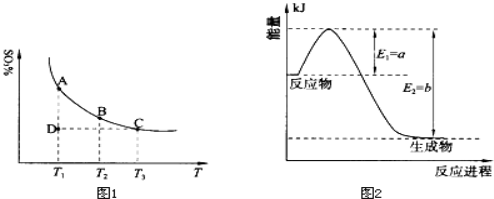
①恒温、恒压条件下,反应2SO2(g)+O2(g) 2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2(填“>”、“<”或“=”,下同);若反应进行到状态D时,v正 v逆(填“>”、“<”或“=”)。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①上图2是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: .(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水.在25℃下,将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液恰好显中性,用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)已知25°C时Ksp[AgCl]=1.6×10-10mol2•L-2,Ksp[AgI]=1.5×10-16mol2•L-2),在25℃下,向0.1L0.002mol•L-1的NaCl溶液中逐滴加入0.1L0.002mol•L-1硝酸银溶液,有白色沉淀生成.从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1L0.002mol•L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
2SO3(g)是制备硫酸的重要反应,该反应为放热反应。降低温度,逆反应的速率_________;使用催化剂V2O5,正反应的速率__________ (以上填“增加”、“不变”或“减小”)。











