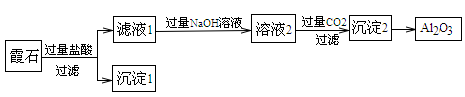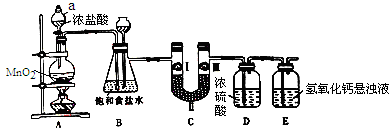-
日常生活中许多现象与氧化还原反应有关,下列现象与氧化还原反应无关的是
A.古铜币上出现铜绿[Cu2(OH)2CO3] B.铝制用品表面变暗
C.钢铁生锈 D.氢氧化钠固体潮解
难度: 简单查看答案及解析
-
为了除去镀在铁制品表面的铜镀层,可选用的试剂是
A.稀硝酸 B.浓硝酸 C.浓硫酸 D.浓盐酸
难度: 中等查看答案及解析
-
下列各组离子在加入Na2O2后能大量共存的是
A.K+、H+、NO3-、SO32- B.CO32-、Cl-、Fe2+、NH4+ -
C.Cu2+、Cl-、SO42-、K+ D.Ba2+、K+、NO3-、Cl-
难度: 中等查看答案及解析
-
下列试剂,既能与Na2CO3溶液反应,又能与NaHCO3的是
A.CaCl2溶液 B.BaCl2溶液
C.NaOH溶液 D.Ba(OH)2溶液
难度: 中等查看答案及解析
-
将0.2molCO2通入装有足量Na2O2的干燥管中,干燥管增重的质量为
A.2.8g B.5.6g C.8.8g D.11.2g
难度: 中等查看答案及解析
-
2015年10月,屠呦呦因发现青蒿素和双氢青蒿素治疗疟疾的新疗法而获得诺贝尔生理学或医学奖。双氢青蒿素的化学式为C15H24O5,相对分子质量为284。下面关于双氢青蒿素的说法正确的是
A.1mol双氢青蒿素的质量为284g∙mol-1
B.双氢青蒿素的摩尔质量等于它的相对分子质量
C.14.2g双氢青蒿素中含有的原子总数为2.2NA
D.含有6.02×1023个碳原子的双氢青蒿素的物质的量为1mol
难度: 中等查看答案及解析
-
亚硝酸(HNO2)在反应中既可作氧化剂,又可作还原剂。当它作氧化剂时,其还原产物可能是
①NO ②NO2 ③HNO3 ④N2 ⑤NH3
A.①③ B.①②④ C.①④⑤ D.全部
难度: 中等查看答案及解析
-
下列装置或操作不能达到实验目的的是
目的
A.实验室制取并收集O2
B.检查装置气密性
C.制取蒸馏水
D.分离水和四氯化碳
装
置
或
操
作
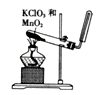

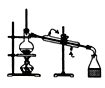
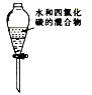
难度: 中等查看答案及解析
-
下列转化中,均不能通过一步反应实现的是
A.Na2O2→Na2CO3→NaOH B.SiO2→Si→Na2SiO3
C.NH3→NO2→HNO3 D.S→SO2→NaHSO3
难度: 简单查看答案及解析
-
如图是产生和收集气体的实验装置,该装置最适合于( )
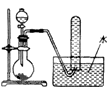
A.用浓硝酸和Cu反应制取NO2
B.用浓盐酸和MnO2反应制取Cl2
C.用NH4Cl和Ca(OH)2反应制取NH3
D.用H2O2溶液和MnO2反应制取O2
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是
A.钠与水反应:Na+2H2O=Na++2OH-+H2↑
B.向Al2(SO4)3溶液中加入过量NH3∙H2O:Al3++4NH3∙H2O=AlO2-+4NH4++2H2O
C.酸性溶液中KClO3与KCl反应生成Cl2:ClO3-+Cl-+6H+=Cl2↑+3H2O
D.向含1molNaHSO3的溶液中加入1molNa2O2:Na2O2+HSO3-=2Na++SO42-+OH-
难度: 困难查看答案及解析
-
将Na、Al2O3、HCl三种物质依次加入水中充分反应后,所得溶液中只含有NaCl一种溶质,则Na、Al2O3、HCl的物质的量之比可能为
A.1:2:1 B.3:2:1 C.2:3:1 D.1:2:3
难度: 简单查看答案及解析
-
为除去下列物质中所含的杂质,所选用的试剂或操作方法不正确的是
序号
物质
杂质
除杂所用的试剂或操作方法
A
KNO3溶液
KOH
滴入稀HNO3的同时用pH试纸测定至溶液呈中性
B
FeSO4溶液
CuSO4
加入过量铁粉并过滤
C
H2
CO2
依次通过盛有NaOH溶液和浓硫酸的洗气瓶
D
NaNO3
CaCO3
加稀盐酸溶解、过滤、蒸发、结晶
难度: 中等查看答案及解析
-
某实验小组设计实验测定Na2SO4和Na2CO3混合物中各组分的含量。
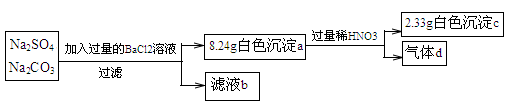
下列说法不正确的是
A.沉淀a的主要成分是BaSO4和BaCO3
B.滤液b中Na+的物质的量为0.08mol
C.气体d在标准状况下的体积为224mL
D.原混合物中Na2SO4与Na2CO3的物质的量之比为1:3
难度: 中等查看答案及解析
-
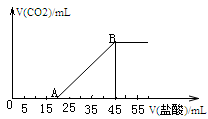
向浓度均为0.1mol∙L-1的HNO3、Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成沉淀的物质的量与加入NaOH溶液的体积的关系,其中合理的是

难度: 中等查看答案及解析
-
向含有a molFeBr2的溶液中通入x molCl2。下列各项通入Cl2,溶液内发生反应的离子方程式,其中不正确的是
A.当x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.当x=0.6a,2Br-+Cl2=Br2+2Cl-
C.当x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.当x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
难度: 简单查看答案及解析