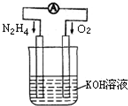
-
下列关于能量转换的认识中不正确的是( )
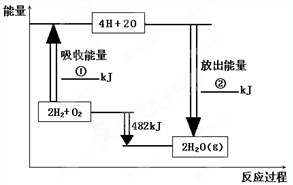
A.电解水生成氢气和氧气时是电能转化为化学能
B.原电池放电是将化学能转化为电能
C.绿色植物光合作用是将光能转化为化学能
D.白炽灯工作时是将电能全部转化为光能难度: 中等查看答案及解析
-
保存过氧化氢的试剂瓶上最适合贴上的一个标签是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
相同条件下,同浓度的下列溶液,其pH值最大的是( )
A.Na2CO3
B.CH3COONa
C.NaCl
D.NaHSO4难度: 中等查看答案及解析
-
关于强电解质和弱电解质的说法正确的是( )
A.强电解质溶液的导电能力一定比弱电解质溶液强
B.强电解质的水溶液中不存在分子
C.弱电解质的水溶液中既存在分子又存在自由移动的离子
D.因为NH3•H2O是弱电解质,所以在AlCl3溶液中加入氨水不能制取Al(OH)3沉淀难度: 中等查看答案及解析
-
下列说法正确的是( )
A.如果苯酚溶液沾到皮肤上,应立即用氢氧化钠溶液洗涤
B.重结晶时,溶液冷却速度越慢得到的晶体颗粒越小
C.用新制的Cu(OH)2浊液可以检验牙膏中的甘油
D.将3~4根火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液和稀HNO3,可以检验火柴头中的氯元素难度: 中等查看答案及解析
-
化学家庭小实验是利用家庭日常生活用品进行化学学习和探究的活动.下列家庭小实验设计肯定不合理的是( )
A.用米汤检验食用加碘盐中是否含碘元素
B.用食醋检验鸡蛋壳中是否含有碳酸盐
C.用食用碱(Na2CO3)溶液洗涤餐具上的油污
D.在自来水中加入明矾起到净水作用难度: 中等查看答案及解析
-
下列说法中有明显错误的是( )
A.升高温度,一般可使活化分子的百分数增大,因而反应速率增大
B.活化分子之间发生的碰撞一定为有效碰撞
C.干冰升华这一过程中,△S>0
D.对于反应:CO (g)+H2O (g)CO2(g)+H2(g),恒容时,温度升高,H2浓度增大,则该正反应的焓变为正值
难度: 中等查看答案及解析
-
如图所示,比较不同浓度的硫代硫酸钠溶液和同浓度的硫酸反应的速率大小的实验中,锥形瓶瓶底衬有画了“十”字的白纸,先向瓶内加入硫代硫酸钠溶液,再加入硫酸溶液.需记录反应所需的时间,正确的记时方法是( )

A.加入硫代硫酸钠溶液后即开始记时,瓶中出现浑浊现象时记时结束
B.加入硫代硫酸钠溶液后即开始记时,加入硫酸溶液后记时结束
C.加入硫酸溶液后即开始记时,瓶中出现浑浊现象记时结束
D.加入硫酸溶液后即开始记时,至看不到瓶底“十”字记时结束难度: 中等查看答案及解析
-
下列过程或现象与盐类水解无关的是( )
A.0.1 mol•L-1 NaAc溶液中,c(Ac-)小于0.1 mol•L-1
B.镁粉加入氯化铵溶液中有气体生成
C.加热稀氨水其溶液pH值稍有变化
D.加入CuO固体可以除去CuCl2溶液中少量的FeCl3难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.用惰性电极电解滴有紫色石蕊试液的饱和食盐水,阴极区附近溶液先变红
B.镀锌的铁制品,镀层部分受损后,露出的铁表面易被腐蚀
C.用惰性电极电解CuSO4溶液,在电解后溶液中加Cu(OH)2固体能使CuSO4溶液恢复到电解前浓度
D.若要在一些金属制品表面镀一层银,则以待镀金属制品作阴极,银作阳极,含有银离子的溶液作电解质溶液难度: 中等查看答案及解析
-
常温下,下列有关水的电离平衡:H2O⇌H++OH-△H>0,叙述正确的是( )
A.向水中加入少量固体碳酸氢钠,平衡向右移动,KW不变,c(OH-)增大
B.向水中加入稀氨水,平衡向左移动,c(OH-)降低
C.向水中加入少量金属Na,平衡向左移动,c(OH-)降低
D.将水加热,平衡向右移动,KW增大,pH增大难度: 中等查看答案及解析
-
亚硝酸钠外观与食盐相似,生活中若误食亚硝酸钠会导致中毒.下列方法不能用来鉴别亚硝酸钠和食盐的是( )
A.将两种固体分别溶于水配成溶液,在酸性条件下加入KI淀粉溶液
B.将两种固体分别溶于水配成溶液,在酸性条件下加入FeCl2溶液
C.将两种固体分别溶于水配成溶液,加入AgNO3溶液
D.将两种固体分别溶于水配成溶液,加入稀硫酸并微热难度: 中等查看答案及解析
-
向Cr2(SO4)3的水溶液中加入NaOH溶液,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多;但当pH>13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO22-).其平衡关系如下:
Cr3+(紫色)+3OH-⇌Cr(OH)3(灰绿色)⇌CrO22-(亮绿色)+H++H2O
向0.05mo1•L-1 Cr2(SO4)3溶液50mL中,加入1.0mol•L-1NaOH溶液50mL,充分反应后,溶液中可观察到的现象是( )
A.溶液为紫色
B.溶液中有灰绿色沉淀
C.溶液为亮绿色
D.无法判断难度: 中等查看答案及解析
-
下图装置中,U型管内为红墨水,a,b试管内分别盛有食盐水和稀醋酸溶液,各加入生铁块,放置一段时间后,下列有关描述正确的是( )
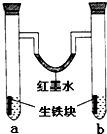
A.红墨水柱两边的液面变化是左高右低
B.b试管中溶液pH值减小
C.两试管中相同的电极反应式是:Fe-3e-=Fe3+
D.a试管中阳极反应式为:O2+2H2O-4e-=4OH-难度: 中等查看答案及解析
-
下列叙述中,正确的是( )
A.中和10mL 0.1 mol•L-1HAc与中和100mL 0.01 mol•L-1HAc所需NaOH的物质的量不同
B.10mL 0.1 mol•L-1氨水与100mL 0.01 mol•L-1氨水,其OH-物质的量相同
C.相同条件下,将pH值相同的盐酸和醋酸稀释相同的倍数,盐酸pH值变化较大
D.锌分别与pH=3的盐酸和pH=3的醋酸溶液反应,起始反应速率盐酸较快难度: 中等查看答案及解析
-
下列离子方程式书写错误的是( )
A.氧化铝溶于强碱溶液中:3H2O+Al2O3+2OH-=2Al(OH)4-
B.在苯酚钠溶液中通入CO2气体:2C6H5O-+H2O+CO2→2C6H5OH+CO32-
C.用惰性电极电解硫酸铜溶液:2Cu2++2H2O2Cu+O2↑+4H+
D.在海带中提取碘元素时,在滤液中加入适量的稀硫酸和双氧水:2H++2I-+H2O2=I2+2H2O难度: 中等查看答案及解析
-
下列实验操作正确的是( )
A.纸层析法分离铁离子和铜离子的实验中,应将滤纸上的试样点浸入展开剂中
B.硝酸钾晶体的制备实验中,蒸发浓缩硝酸钠和氯化钾的混合溶液,氯化钠晶体析出后趁热过滤,承接滤液的烧杯应预先加蒸馏水,以防降温氯化钠溶液达饱和而析出
C.海带中碘元素的分离及检验的实验中,将海带灰用蒸馏水浸泡,煮沸2~3 min,取其浸取液,向其中加入四氯化碳萃取其中的碘
D.乙醇的脱水反应(制乙烯)实验中,反应的温度应控制在170℃,温度计的水银球应处于支管口处难度: 中等查看答案及解析
-
在固定体积的密闭容器中,发生:N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ•mo1-1,右图表示在时间t~t7中反应速率与反应过程的曲线图,则容器内氨的百分含量最高的一段时间是(只改变单一的条件)( )
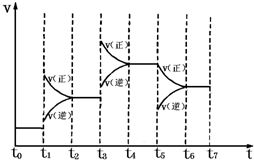
A.t~t1
B.t2~t3
C.t4~t5
D.t6~t7难度: 中等查看答案及解析
-
下列各溶液中,微粒的物质的量浓度关系不正确的是( )
A.0.1 mol•L-1NaHCO3溶液中:c(H2CO3)>c(CO32-)
B.0.1 mol•L-1Na2CO3溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
C.0.1 mol•L-1的NH4Cl溶液与0.05 mol•L-1的NaOH溶液等体积混合,其混合溶液中:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)
D.浓度均为0.1 mol•L-1的NH4Cl、CH3COONH4、NH4HCO3溶液的pH大小顺序:pH(CH3COONH4)>pH(NH4HCO3)>pH(NH4Cl)难度: 中等查看答案及解析
-
完全燃烧一定质量的无水甲醇生成CO2 和水蒸气放出热量为Q,已知为了完全吸收生成的CO2,消耗8mol•L-1NaOH溶液50mL,则完全燃烧1mol无水甲醇产生CO2气体和液态水放出的热量不可能是( )
A.5Q
B.小于2.5Q
C.大于5Q
D.2.5Q~5Q难度: 中等查看答案及解析