-
在火星上工作的美国“勇气号”、“机遇号”探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过水。以下叙述正确的是 ( )
A. 铝热剂就是单指Fe2O3粉和铝粉的混合物
B. 检验从火星上带回来的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液
C. 分别还原a mol Fe2O3所需H2、Al、CO的物质的量之比为3:2:3
D. 明矾属硫酸盐,含结晶水,是混合物
难度: 中等查看答案及解析
-
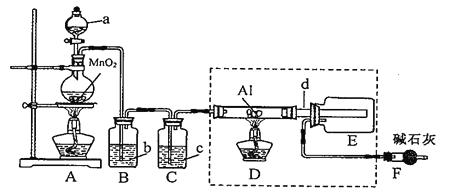
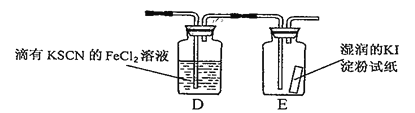
下列叙述正确的是( )
A. 稀盐酸可除去烧瓶内残留的MnO2 B. 可用磨口玻璃瓶保存NaOH溶液
C. 稀硝酸可除去试管内壁的银镜 D. 煮沸自来水可除去其中的CaCO3
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,32gSO3的体积约为11.2L
B. 2.0gH218O与D2O的混合物中所含中子数为NA
C. 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA
D. 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是
A. X的简单氢化物的热稳定性比W的强
B. Y的简单离子与X的具有相同的电子层结构
C. Y与Z形成的化合物的水溶液可使蓝色石蕊试纸变红
D. Z与X属于同一主族,与Y属于同一周期
难度: 困难查看答案及解析
-
化学反应中会出现“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是( )
①过量稀硫酸与块状石灰石;②过量的氢气与少量氮气在催化剂存在下充分反应;
③过量稀硝酸与银反应;④过量铜与浓硫酸;
⑤浓盐酸与过量的MnO2 ⑥过量的锌与18mol/L的硫酸反应;
A. ③④⑥ B. ②③⑤ C. ①②④⑤ D. ①②③④⑤⑥
难度: 中等查看答案及解析
-
对四种无色溶液进行离子检验,实验结果如下,其中明显错误的是
A.K+、Na+、Cl-、NO3- B.Na+、NO3-、OH-、CO32-
C.Na+、OH-、Cl-、NO3- D.MnO4-、K+、S2-、Na+
难度: 简单查看答案及解析
-
下列混合物的分离或提纯操作中不正确的是( )
A. 除去N2中的少量O2,可通过灼热的Cu网后,收集气体
B. 除去Fe(OH)3胶体中混有的Cl- 离子,可用渗析的方法
C. 除去乙醇中的少量NaCl,可用蒸馏的方法
D. 重结晶、滴定操作都可用于提纯物质
难度: 中等查看答案及解析
-
甲、乙、丙、丁四位同学分别进行实验,测定四份不同澄清溶液的成分,记录如下
表,其中记录合理的是
甲
K2SO4、BaCl2、NH4NO3
乙
NaCl、Ca(OH)2、K2CO3
丙
HCl、Na2SO3、NaCl
丁
K2SO4、NaNO3、KCl
A.甲 B.乙 C.丙 D.丁
难度: 困难查看答案及解析
-
在反应3S+6KOH=2K2S+K2SO3+3H2O中,被还原的硫和被氧化的硫的质量比为:
A.2:1 B.1:2 C.3:1 D.1:3
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1 mol·L-1 NaCl溶液中含有的Na+离子数目为0.1NA
B. 室温下,1L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C. 5NH4NO3
2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
D. 常温下,2.24LCl2完全与NaOH溶液反应,转移的电子数目一定为0.1NA
难度: 中等查看答案及解析
-
下列有关物质的工业制法中,错误的是
A. 制硅:用焦炭还原二氧化硅得硅
B. 制钠:以海水为原料制得NaCl,再电解熔融NaCl得钠
C. 制铁:以焦炭和铁矿石为原料,用CO还原铁矿石得铁
D. 制镁:以海水为原料,经一系列过程制得氯化镁,用H2还原MgCl2得镁
难度: 中等查看答案及解析
-
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子可能是
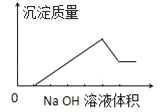
A. Mg2+、Al3+、Fe3+ B. Na+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. H+、Mg2+、Al3+
难度: 中等查看答案及解析
-
根据实验目的判断下列实验操作或装置正确的是( )

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列反应的离子反应方程式正确的是: ( )
A. 过量的二氧化碳通入NaOH溶液中:CO2+OH-==HCO3-
B. 氯气通入水中:Cl2+ H2O==Cl-+ ClO- + 2H+
C. 硫酸亚铁溶液加入过氧化氢溶液 Fe2++2H2O2+4H+ ==Fe3++4H2O
D. 向AlCl3溶液中过量的氨水:Al3+十4NH3·H2O==AlO2-十4NH4+十2H2O
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
①将金属Na投入水中:2Na+2H2O=2Na++2OH-+H2↑
②在硫酸溶液中加入氢氧化钡溶液至中性:Ba2++OH-+H++SO2-4=BaSO4↓+H2O
③碳酸氢钠溶液中滴加盐酸:HCO3-+H+=CO2↑+H2O
④氢氧化钠中滴加醋酸:OH-+H+=H2O
A. ①③④ B. ①③ C. ②④ D. ①②③
难度: 中等查看答案及解析