-
下列关于元素周期表的说法中不正确的是
A.催化剂一般在过渡元素中寻找
B.过渡元素全部是金属元素,因此它们又被称为过渡金属
C.元素周期表中只有7个主族和7个副族
D.稀有气体元素原子的最外层电子数为2或者8
难度: 简单查看答案及解析
-
储存浓H2SO4 的铁罐外口会出现严重的腐蚀现象,这体现浓H2SO4的
A.吸水性和酸性 B.脱水性和吸水性
C.强氧化性和吸水性 D.不挥发性和酸性
难度: 简单查看答案及解析
-
甲乙两种非金属:①甲比乙容易与H2化合;②甲的氢化物比乙的氢化物稳定③
甲的最高价氧化物对应的水化物的酸性比乙的最高价氧化物对应的水化物酸性强;
④与某金属反应时甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低。能说
明甲比乙的非金属性强的是
A.只要④ B.只有⑤ C.①②③④⑤ D.①②③
难度: 简单查看答案及解析
-
为除去CO2气体中混有少量杂质SO2气体,应选用的试剂是
A.Na2CO3溶液 B.饱和NaHCO3溶液 C.NaOH溶液 D.Ba(OH)2溶液
难度: 简单查看答案及解析
-
1L稀H2SO4 和稀H NO3的混合液,其物质的量浓度分别为0.4mol·L-1和0.1mol·L-1。若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量为
A.2.4g B.3.2g C.6.4g D.9.6g
难度: 简单查看答案及解析
-
北京2008奥运会金牌为金镶玉,直径为70mm,厚6mm。某化学兴趣小组对金牌中金属的成分提出猜想:甲认为该金属是由纯金制成;乙认为该金属是由金银合金制成;丙认为该金属是由黄铜(铜锌合金)制成。为了验证他们的猜想,取制造这种金牌的材质粉末少量进行实验,加入下面一种试剂来证明他们猜想的正误,该试剂应是
A.硫酸铜溶液 B.盐酸 C.稀硝酸 D.硝酸银溶液
难度: 简单查看答案及解析
-
以下非金属氧化物与其引起的环境问题及主要来源对应正确的是
氧化物 环境问题 主要来源
A CO2 酸雨 化石燃料的燃烧
B SO2 温室效应 汽车尾气的排放
C NO2 光化学烟雾 工厂废气的排放
D CO CO中毒 燃料的不完全燃烧
难度: 简单查看答案及解析
-
下列分子中所有原子未全部满足最外层为8个电子结构的是
A.CCl4 B.CO2 C.BF3 D.PCl3
难度: 简单查看答案及解析
-
能说明A元素非金属性比B元素非金属性强的是
A原子得到电子的数目比B原子少
B.A元素的最高正价比B元素的最高正价要高
C.气态氢化物溶于水后的酸性:A比B强
D.A单质能与B的氢化物水溶液反应,生成B单质
难度: 简单查看答案及解析
-
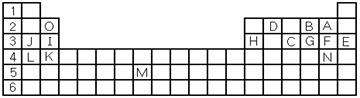
几种短周期元素的原子半径及某些化合价见下表。分析判断下列说法正确的是
元素代号
A
B
D
E
G
I
J
K
化合价
–1
–2
+4、–4
–1
+5、–3
+3
+2
+1
原子半径/nm
0.071
0.074
0.077
0.099
0.110
0.143
0.160
0.186
A.K不能与水反应
B.A、I、J的离子半径由大到小顺序是A>J>I
C.G元素的单质不存在同素异形体
D.J在DB2中燃烧生成两种化合物
难度: 简单查看答案及解析
-
能正确表示下列反应的离子方程式是
A.向Fe(NO3)2稀溶液中加入盐酸: 3Fe2++4H++NO3-===3Fe3++NO↑+2H2O
B.铜片与浓HNO3: Cu+NO3-+4H+===Cu2++NO↑+2H2O
C.碳酸氢铵溶液与足量的NaOH溶液混合后加热: NH4++OH-
NH3↑+H2O
D.AlCl3溶液中滴加足量氨水: Al3++4NH3·H2O===AlO2-+4NH4++2H2O
难度: 简单查看答案及解析
-
四支试管分别充满O2、NO2、C12、NH3四种气体,把它们分别倒立于盛有下列各种液体的水槽中,发生的现象如下图所示,其中充满C12的试管是
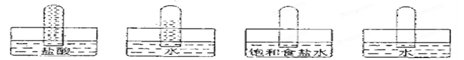
A B C D
难度: 简单查看答案及解析
-
下列物质既能跟浓H2SO4反应,又能与烧碱反应的是
①MgCl2 ②NaHCO3 ③(NH4)2 S ④Al(OH)3
A.只有④ B.除①外 C.除①③ D.全部都可以
难度: 简单查看答案及解析
-
下图中A、B、C、D四条曲线分别表示IVA、VA、VIA、VIIA族元素的气态氢化物的沸点,其中表示VIA族元素气态氢化物沸点的是曲线
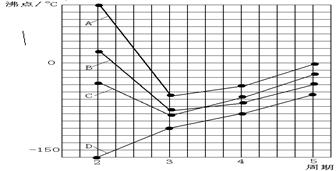
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
将充有amLNO和bmLNO2的试管倒立于水槽中,然后再通入amLO2,若a<b,则充分反应后,试管内剩余气体的体积是
A.(
B.
C.
D.
难度: 简单查看答案及解析
-
实验室不需用棕色试剂瓶保存的是
A.浓硝酸 B.硝酸银 C.氯水 D.浓硫酸
难度: 简单查看答案及解析
-
试管中盛有少量白色固体,可能是铵盐,检验的方法是
A.加水,将湿润的红色石蕊试纸放在试管口
B.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
C.加氢氧化钠溶液,加热,用蘸有浓硫酸的玻璃棒靠近瓶口
D.加氢氧化钠溶液,滴入紫色石蕊试剂
难度: 简单查看答案及解析
-
如图所示:烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻震荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是
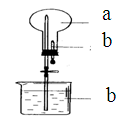
A.a为HCl,b为H2O
B.a为CO2,b为浓NaOH溶液
C.a为Cl2,b为饱和NaCl溶液
D.a为NH3,b为浓NH4Cl溶液
难度: 简单查看答案及解析
-
某无色透明的溶液,一定能大量共存的离子组是
A.Cl-、SO42-、Na+、K+ B.K+、CO32-、Ca2+、NO3-
C.HCO3-、Na+、NO3-、H+ D.NO3-、Cu2+、Cl-、NH4+
难度: 简单查看答案及解析
-
在短周期元素中,若某元素原子的最外层电子数与其电子层数相等,则符合条件的元素种数为
A.1种 B.2种 C.3种 D.4种
难度: 简单查看答案及解析
-
下列说法正确的是
A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.同周期非金属氧化物对应水化物的酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小
难度: 简单查看答案及解析
-
在热的稀硫酸溶液中溶解了45.6gFeSO4。当加入200mL0.5mol?L-1KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3溶液也完全反应,并有NxOy气体逸出,则该NxOy是
A.N2O B.NO C.N2O3 D.NO2
难度: 简单查看答案及解析
-
A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是
A.A、B、C、D、E B.E、C、D、B、A
C.B、A、D、C、E D.C、D、A、B、E
难度: 简单查看答案及解析
-
有一瓶Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀。
对此实验下述结论正确的是
A.Na2SO3已部分被空气中的氧气氧化
B.加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4
C.此实验不能确定Na2SO3是否部分被氧化
D.加硝酸后的不溶沉淀一定是BaSO3
难度: 简单查看答案及解析
-
核电荷数小于l8的某元素X,其原子的电子层数为n,最外层电子数为(2n+1),
原子核内质子数为(2n2-1)。下列关于元素X的说法中,不正确的是
A.其最高化合价为+3 B.可以形成化学式为KXO3的盐
C.其氢化物可以用来做喷泉实验 D.其最高价氧化物的水化物是强酸
难度: 简单查看答案及解析