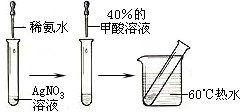
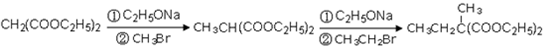-
2008年初,南方经历了50年一遇的大雪灾,导致交通中断,电网大面积瘫痪.为了打通京珠高速,有关部门在京珠高速上撒下了数千吨融雪剂帮助破冰除雪,恢复交通.融雪剂主要分为两大类,一类是以醋酸钾为主要成分的有机融雪剂,虽然这一类融雪剂融雪效果好,没有什么腐蚀损害,但它的价格太高,一般只适用于机场等地.而另一类则是氯盐类融雪剂,包括氯化钠、氯化钙、氯化镁、氯化钾等,通称作“化冰盐”.它的优点是便宜,价格仅相当于有机类融雪剂的1/10,但它对大型公共基础设施的腐蚀是很严重的.下列说法中不正确的是( )
A.通过在熔融状态下能否导电来证明CaCl2是否为离子化合物
B.CaCl2通常用作干燥剂,但是不能干燥NH3
C.电化学腐蚀是造成钢铁腐蚀的主要原因
D.“化冰盐“可以替代食盐来作调味剂,氯盐类融雪剂不会造成地下水污染难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价见下表:
下列叙述正确的是( )元素代号 K L M Q R T N 原子半径/nm 0.183 0.160 0.143 0.102 0.089 0.074 0.152 主要化合价 +1 +2 +3 +6、-2 +2 -2 +1
A.K、L、M三元素的金属性逐渐增强
B.在RCl2分子中,各原子均满足8电子的稳定结构
C.Q元素的最高价氧化物为电解质,其水溶液能够导电
D.K在T单质中燃烧所形成的化合物中含有非极性共价键和离子键难度: 中等查看答案及解析
-
2007年诺贝尔化学奖授予德国化学家格哈德•埃特尔是因为他在表面化学所作的研究.以下事实或现象与表面化学无密切关系的是( )
A.配制FeCl3溶液时将FeCl3固体溶于浓盐酸中再加水稀释
B.用还原铁粉和石棉绒混合物与水蒸气制得Fe3O4和H2
C.用明矾来净水
D.熔化的铝不易滴落下来难度: 中等查看答案及解析
-
2007年10月,一台湾女孩因食用河虾后服用大剂量的维生素C而中毒.菜谱中记载:河虾不宜与西红柿同食.主要原因是河虾中含有五价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的3价砷.下列说法正确的是( )
A.在该反应中维生素C作催化剂
B.砒霜是砷的氧化物,由上述信息可推知砒霜中含有的砷可能是3价砷
C.因为河虾中含有砷元素,所以不能食用
D.上述反应中维生素作氧化剂难度: 中等查看答案及解析
-
对经常出现的客观现象进行归纳可以形成相应规律,但客观事物有时也会有违背普遍规律的现象,寻找例外现象出现的原因正是科学发展的内在动力.下列事实与相关规律不相吻合并有其内在原因的是( )
A.Cs是很活泼的金属
B.I2易溶于四氯化碳
C.HF在标准状况下是液体
D.Cl在第三周期中原子半径最小难度: 中等查看答案及解析
-
下列有关工业生产的叙述不正确的是( )
A.合成氨生产过程中将NH3液化分离,可提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO2转化为SO3时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阳极室产生的Cl2进入阴极室
D.电解精炼铜时,同一时间内阳极减少的质量比阴极增加的质量小难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数值,下列说法正确的是( )
A.8.2gNa218O2与过量的H216O作用,生成的氧气中含有的中子数为0.8NA
B.1.4g乙烯和丙烯的混合物中含碳原子数为0.lNA
C.2.24L(标准状况)Cl2与足量NaOH溶液在常温下反应.转移的电子数为0.2NA
D.6.4gCaC2晶体中含有阴阳离子总数为0.3NA难度: 中等查看答案及解析
-
雷达的微波过滤器里使用铁氧磁性体,如钇铁石榴石Y3Fe5O12,其中Y是ⅢB族稀土元素.下面有关钇铁石榴石的叙述中正确的是( )
A.可表示为3YO3•3FeO•Fe2O3
B.可表示为Y3O5•Fe3O4•Fe2O3
C.其中钇、铁的化合价均为+3价
D.其中钇、铁的化合价均有+2、+3价难度: 中等查看答案及解析
-
Al(OH)3难溶于水,某温度下,只要溶液中Al3+物质的量浓度(mol/L)和OH-物质的量浓度(mol/L)3次方的乘积大于1.9×10-33,就会析出Al(OH)3沉淀,则0.10mol/L AlCl3不产生沉淀的最大OH-物质的量浓度(mol/L)为( )
A.1.9×10-33
B.2.7×10-11
C.8.7×10-8
D.1.2×10-11难度: 中等查看答案及解析
-
质量分数为n的NaOH溶液,其物质的量浓度为amol/L,加热蒸发水使其质量分数变为2n,此时,该溶液中的物质的量浓度为bmol/L,则a与b的关系正确的是( )
A.b>2a
B.b<2a
C.b=2a
D.a=2b难度: 中等查看答案及解析
-
对可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述正确的是( )
A.平衡时,v正(O2)=v逆(O2)必成立
B.关系式5v正(O2)=4v正(NO)总成立
C.用上述四种物质NH3、O2、NO、H2O表示的正反应速率的数值中,v正(H2O)最大
D.若投入4molNH3和5molO2,通过控制外界条件,必能生成4molNO难度: 中等查看答案及解析
-
下列离子方程式中正确的是( )
A.NaHSO4溶液中加Ba(OH)2溶液至中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH‑=NH3↑+H2O
C.AlCl3溶液中滴加浓氨水至过量:Al3++4NH3•H2O=AlO2-+4NH4++2H2O
D.向硫酸亚铁的酸性溶液中滴入双氧水:2Fe2++H2O2+2H+=2Fe3++2H2O难度: 中等查看答案及解析
-
下列各种情况下,常温下溶液中可能大量存在的离子组是( )
A.由水电离出的c(H+)=l×10-12mol/L的溶液中:K+、Ba2+、OH-、NO3-
B.加入铝粉能放出大量H2的溶液中:Na+、SO42-、Cl-、NH4+
C.pH=7的中性溶液中:Fe3+、Cl-、HCO3-、K+
D.使pH试纸呈红色的溶液中:K+、Fe2+、NO3-、MnO4-难度: 中等查看答案及解析
-
一定条件下用甲烷可以消除氮氧化物(NOx)的污染.已知:
①CH4 ( g )+4NO2( g )═4NO( g )+CO2( g )+2H2O( g )△H=-574kJ•mol-1
②CH4 ( g )+4NO( g )═2N2( g )+CO2( g )+2H2O( g )△H=-1160kJ•mol-1.
下列正确的选项是( )
A.CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=-867kJ•mol-1
B.CH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子总数为3.2mol
C.若0.2molCH4还原NO2至N2,在上述条件下放出的热量为173.4kJ
D.若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为3.2mol难度: 中等查看答案及解析
-
下列各组物质中,不是按
(“→”表示一步完成)关系相互转化的是( )
选项 A B C D a Fe CH2=CH2 Al(OH)3 H2SO4 b FeCl3 CH3-CH2Br NaAlO2 SO2 c FeCl2 CH3CH2OH Al2O3 SO3
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
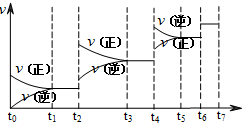
对于反应N2O4(g)
2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是( )

A.A、C两点的正反应速率的关系为v(A)<v(C)
B.A、B、C、D、E各状态中,v(正)<v(逆)的是状态E
C.维持p1不变,E→A所需时间为x;维持p2不变,D→C所需时间为y,则x<y
D.使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是从p1突然加压至p2,再由p2无限缓慢降压至p1难度: 中等查看答案及解析
-
已知25℃时有关弱酸的电离平衡常数:
则下列有关说法正确的是( )弱酸化学式 CH3COOH HCN H2CO3 电离平衡常数(25℃) 1.8×10-5 4.9×10-10 K1=4.3×10-7
K2=5.6×10-11
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
C.amol•L-1HCN溶液与bmol•L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
D.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小难度: 中等查看答案及解析
-
某研究小组用NaOH溶液吸收二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴阳膜组合循环再生机理如图,则下列有关说法错误的是( )

A.阳极区酸性增强
B.阴极区电极反应式为:2H++2e-=H2↑
C.diluent和concentrated的中文含义为浓缩的、稀释的
D.该过程中的副产品主要为H2SO4难度: 中等查看答案及解析