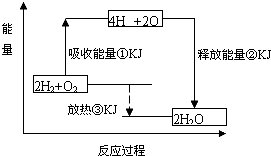
-
甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5kJ热量,则表示甲烷燃烧热的热化学方程式为( )
A.2CH4(g)+4O2(g)═2CO2(g)+4H2O(l);△H═+890kJ•mol-1
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H═+890kJ•mol-1
C.CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H═-890kJ•mol-11
D.2CH4(g)+4O2(g)═2CO2(g)+4H2O(l);△H═-890kJ•mol-1-1难度: 中等查看答案及解析
-
下列各组顺序的排列不正确的是( )
A.原子半径:Na<Mg<Al
B.热稳定性:HCl>H2S>PH3
C.酸性强弱:H2SiO4<H2CO3<H3PO4
D.溶点:NaCl>Na>CO2难度: 中等查看答案及解析
-
某粒子用符号zAMn+表示,下列关于该粒子的叙述中,正确的是( )
A.所含质子数为(A-n)
B.所含中子数为(A-Z-n)
C.所含电子数为(Z+n)
D.中子数-电子数=A-2Z+n难度: 中等查看答案及解析
-
可逆反应H2(g)+I2(g)≒2HI(g)达到限度时的标志是( )
A.混合气体密度恒定不变
B.混合气体的颜色不再改变
C.H2、I2、HI的浓度相等
D.混合气体压强不变难度: 中等查看答案及解析
-
下列措施对增大反应速率明显有效的是( )
A.Al在氧气中燃烧生成A12O3,将Al粉改为Al片
B.Fe与稀盐酸反应制取H2时,改用氢离子浓度相同的稀硫酸
C.Zn与稀硫酸反应时,适当提高溶液的温度
D.Na与水反应时增大水的用量难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.离子化合物中一定不含共价键,共价化合物中一定不含离子键
B.水分子呈直线形,氨分子呈三角锥形
C.碳原子之间可形成碳碳单键、碳碳双键或碳碳叁键
D.分子间作用力越大,分子的热稳定性就越大难度: 中等查看答案及解析
-
以下关于元素周期表的结构叙述正确的是( )
A.元素周期表有七个主族,八个副族
B.元素周期表有三个长周期(均含18种元素),三个短周期(均含8种元素)
C.第三主族位于元素周期表的第三列(从左往右)
D.零族位于元素周期表的第18列(从左往右)难度: 中等查看答案及解析
-
下列各项所述的两个量,前者一定大于(或高于)后者的是( )
A.F2和Br2的沸点
B.H-和H+的离子半径
C.同温下同压分别在1升水中最多能溶解的Cl2和SO2的体积
D.在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数难度: 中等查看答案及解析
-
现代城市空气污染物之一NO主要来源于汽车尾气,汽车尾气中产生NO的原因是( )
A.汽车燃料油(如汽油、柴油)中含氮,NO是其燃烧产物
B.是空气中的N2和汽车燃料油发生了化学反应
C.是汽车排出的高温尾气导致空气中的N2和O2发生化合反应
D.空气中的N2与O2在汽车汽缸内的高温环境下发生反应的产物难度: 中等查看答案及解析
-
2011年1月18日,杭州下了今年的第一场雪,出现了严重的冰冻.为使道路积雪消融,环卫工人使用了氯化钠、氯化钙等“化冰盐”.下列说法正确的是( )
A.用“化冰盐”融雪属于化学变化
B.估计MgCl2也可用作“化冰盐”
C.使用“化冰盐”可使水分子结构发生变化
D.大量使用这些“化冰盐”不会造成环境污染难度: 中等查看答案及解析
-
关于元素周期表的说法正确的是( )
A.元素周期表有8个主族
B.ⅠA族的元素全部是金属元素
C.元素周期表有7个周期
D.短周期是指第一、二周期难度: 中等查看答案及解析
-
下列表示物质结构的化学用语或模型正确的是( )
A.8个中子的碳原子的核素符号:12C
B.HF的电子式:
C.Cl-离子的结构示意图:
D.CH4分子的比例模型:难度: 中等查看答案及解析
-
下列说法中,错误的是( )
A.任何化学反应都伴随物质变化和能量变化
B.反应物的总能量低于生成物的总能量时,发生的是吸热反应
C.有些放热反应也需要加热才能发生
D.原电池在工作时,电能被转变为化学能难度: 中等查看答案及解析
-
以下是一些分子的比例模型,其中错误的是( )
A.
HCl
B.
CO2
C.
NH3
D.
CH4难度: 中等查看答案及解析
-
据报道,科学家已成功合成了少量N4,有关N4的说法不正确的是( )
A.N4和N2互为同素异形体
B.N4形成的晶体为原子晶体
C.相同质量的N4和N2所含原子个数比为1:1
D.N4的摩尔质量是56g﹒mol-1难度: 中等查看答案及解析
-
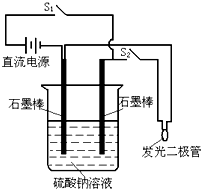
如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )

A.a为负极、b为正极
B.d为阳极,电极反应为:2Cl--2e-=Cl2↑
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变难度: 中等查看答案及解析
-
如图装置,电流计指针会偏转,正极变粗,负极变细,符合这种情况的是( )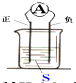
A.正极:Cu 负极:Zn S:稀H2SO4
B.正极:Zn 负极:Cu S:CuSO4溶液
C.正极:Ag 负极:Zn S:AgNO3溶液
D.正极:Fe 负极:Cu S:AgNO3溶液难度: 中等查看答案及解析
-
研究下表信息可直接得出的结论是( )

A.元素性质随原子序数的递增而呈周期性变化
B.同周期元素的非金属性随原子序数递增而增强
C.第VIIA族元素的金属性随电子层数增加而减弱
D.第VIIA族元素的非金属性随电子层数的增加而减弱难度: 中等查看答案及解析
-
普通锌锰干电池的简图(如图所示),它是用锌皮制成的锌筒作电极兼做容器,中央插一根碳棒,碳棒顶端加一铜帽.在石墨碳棒周围填满二氧化锰和炭黑的混合物,并用离子可以通过的长纤维纸包裹作隔膜,隔膜外是用氯化锌、氯化铵和淀粉等调成糊状作电解质溶液;该电池工作时的总反应为:
Zn+2NH4++2MnO2=[Zn(NH3)2]2++Mn2O3+H2O
关于锌锰干电池的下列说法中正确的是( )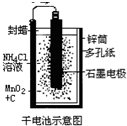
A.当该电池电压逐渐下降后,利用电解原理能重新充电复原
B.电池正极的电极反应式为:2MnO2+2NH4++2e-═Mn2O3+2NH3+H2O
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.1mol电子,锌的质量理论上减小6.5g难度: 中等查看答案及解析
-
下列不能证明氯的非金属性比硫强的实验是( )
A.HCl比H2S稳定
B.HCl溶液(盐酸)的酸性比H2S溶液(氢硫酸)的酸性强
C.氯水滴入氢硫酸溶液中可出现淡黄色沉淀
D.氯气比硫有更强的氧化性难度: 中等查看答案及解析
-
以硫酸铜溶液作电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼.下列叙述正确的是( )
①粗铜与直流电源负极相连
②阴极发生的反应为Cu2++2e-=Cu
③电路中每通过3.01×1023个电子,得到的精铜质量为16g
④杂质Ag以Ag2SO4的形式沉入电解槽形成“阳极泥”
A.②③
B.②④
C.③④
D.①③难度: 中等查看答案及解析
-
在一密闭容器中进行反应:2SO2(g)+O2(g)
2SO3(g) 测得开始时,SO2、O2、和SO3的浓度分别为0.2mol∙L-1、0.1mol∙L-1、0.2mol∙L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是( )
A.O2为0.15mol∙L-1
B.SO2为0.25mol∙L-1
C.SO3为0.4mol∙L-1
D.O2、SO3的浓度相等难度: 中等查看答案及解析
-
不能用
来表示其结构的微粒是( )
A.Ne
B.F-
C.Al3+
D.S2-难度: 中等查看答案及解析
-
J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表.已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素.下列说法错误的是( )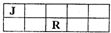
A.J和氢组成的化合物分子有多种
B.工业上不用电解M和T组成的化合物来制备M
C.R、T两元素的气态氢化物中,R的气态氢化物更稳定
D.J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4难度: 中等查看答案及解析