-
化学与科技、医药、工业生产均密切相关。下列有关叙述正确的是
A. 2017年4月26日,中国第二艘航母举行下水仪式,该航母使用了素有“现代工业的骨骼”之称的碳纤维。碳纤维是一种新型的有机高分子材料
B. 离子交换膜在工业上应用广泛,如氯碱工业使用阴离子交换膜
C. 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的主要材料是经提纯的SiO2
D. 获得2015年诺贝尔生理学、医学奖的屠呦呦女士用乙醚从黄花蒿中提取出青蒿素,该技术应用了萃取原理
难度: 中等查看答案及解析
-
某学习兴趣小组讨论辨析以下说法,其中说法正确的是
①通过化学变化可以实现16O与18O间的相互转化
②灼烧钠的化合物时,火焰呈黄色,发生化学反应
③碱性氧化物一定是金属氧化物
④只由一种元素组成的物质一定为纯净物
⑤石墨和C60是同素异形体
⑥糖类、蛋白质、油脂属于天然高分子化合物
A. ③⑤⑥ B. ①② C. ③⑤ D. ①③④
难度: 中等查看答案及解析
-
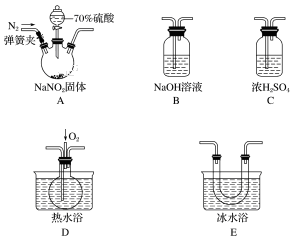
用下列装置不能达到实验目的的是( )

A. 用甲图装置可证明ρ(煤油)< ρ(钠) < ρ(水) B. 用乙图装置制备Fe(OH)2
C. 用丙图装置制取金属锰 D. 用丁图装置制取氯气
难度: 中等查看答案及解析
-
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:

下列说法正确的是
A. CO和O生成CO2是吸热反应
B. 在该过程中,CO断键形成C和O
C. CO和O生成了具有极性共价键的CO2
D. 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
难度: 困难查看答案及解析
-
25 ℃时,下列各组离子在指定溶液中一定能大量共存的是
A. pH=1的无色溶液中:Na+、Cu2+、Cl-、
B. 使酚酞呈红色的溶液中:K+、Na+、NO3-、Cl-
C. 0.1 mol·L-1的FeCl2溶液中:H+、Al3+、SO42-、S2-
D. 由水电离出的c(H+)=1×10-10 mol·L-1的溶液中:Mg2+、NH4+、SO42-、HCO3-
难度: 中等查看答案及解析
-
NA为阿伏伽德罗常数的值,下列叙述正确的是
A. 12g金刚石中含有C-C键数目为2NA
B. 标准状况下,22.4 L己烷含有的共价键数目为19 NA
C. 1L pH=13的NaOH溶液中含有OH-的数目一定为0.1 NA
D. 1mol的 Na2O和BaO2混合物中含有的阴、阳离子总数为3NA
难度: 中等查看答案及解析
-
现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间的关系如图所示,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是
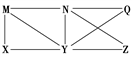
A. X可能为Al或Cl2 B. Y一定为NaOH(aq)
C. N一定是HCl(aq) D. Q、Z中的一种必为Al2O3
难度: 困难查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A. 在FeCl3溶液中投入足量的Zn粉:2Fe3++Zn=Zn2++2Fe2+
B. NaHSO4溶液与Ba(OH)2溶液混合后呈中性:2H++ SO42-+ Ba2++2OH-=BaSO4↓+2H2O
C. 磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+8H+=Fe2++2Fe3++4H2O
D. Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
难度: 中等查看答案及解析
-
已知苯乙烯的结构为
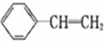 。有关该物质的下列说法正确的是
。有关该物质的下列说法正确的是A. 该物质在一定条件下和氢气完全加成,加成产物的一溴取代物有6种
B. 该物质能使溴水和酸性高锰酸钾溶液褪色,褪色原理完全相同
C. 苯乙烯分子的所有原子不可能在同一平面上
D. 除去
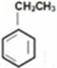 中的苯乙烯可以通入等量氢气反应
中的苯乙烯可以通入等量氢气反应难度: 中等查看答案及解析
-
短周期元素 A、B、C、D、E 的原子序数依次增大,A 的一种核素在考古时常用来鉴定一些文物的年代,B的氢化物的水溶液呈碱性;C、D为金属元素,且D原子最外层电子数等于其 K 层电子数;若往 E 单质的水溶液中滴加少量紫色石蕊试液,可观察到先变红后褪色。下列说法中,正确的是
A. B的最高价氧化物对应的水化物的酸性比E强
B. 某物质焰色反应呈黄色,该物质一定是含C的盐
C. 向D单质与沸水反应后的溶液中滴加酚酞,溶液变红
D. B的氢化物的沸点一定高于A的氢化物
难度: 中等查看答案及解析
-
在通电条件下,用如图所示装置由乙二醛(OHC-CHO)制备乙二酸(H00C-COOH)。其制备反应为:OHC-CHO+2Cl2+2H2O→HOOC-COOH+4HCl。下列说法正确的是
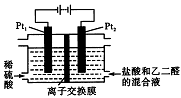
A. 每消耗0.1mol乙二醛在Pt1极放出2.24L气体(标准状况)
B. Pt1的电极反应为:4OH--4e-=2H2O+O2↑
C. 每得到lmol乙二酸将有2molH+从右室迁移到左室
D. 盐酸是起提供Cl-和增强导电性的作用
难度: 困难查看答案及解析
-
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)
CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是
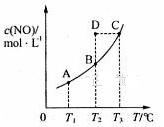
A. 该反应的△H>0
B. 在T2时,若 反 应 体 系 处于 状 态D ,则 此 时
C. 若状态B、C、D的压强分别为PB、PC 、PD ,则PC=PD>PB
D. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
难度: 中等查看答案及解析
-
电解质溶液的电导率越大,导电能力越强。用0.100 mol·L-1的NaOH溶液滴定10.00 mL浓度均为0.100 mol·L-1 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )
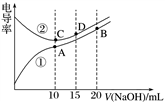
A. 曲线①代表滴定HCl溶液的曲线
B. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. 在相同温度下,A、B、C三点溶液中水的电离程度:C<B<A
D. D点溶液中:c(Cl-)=2c(OH-)-2c(H+)
难度: 困难查看答案及解析
-
根据下列有关实验得出的结论一定正确的是
选项
实验
结论
A
相同温度下,向盛有足量稀硫酸的甲、乙两只试管中分别加入等质量的锌粒,并向甲中加入少量胆矾固体
产生氢气的速率和体积:甲>乙
B
向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液,溶液变黄
氧化性:H2O2>Fe3+
C
相同温度下,将等质量的大理石块和大理石粉分别加入到等体积、等浓度的盐酸中
反应速率:粉状大理石>块状大理石
D
向2mL0.1 mol·L-1Na2S溶液中滴入几滴0.1mol·L-1ZnSO4溶液,生成白色沉淀;再加入几滴0.1 mol·L-1CuSO4溶液,又产生黑色沉淀
溶度积:KSP(ZnS)>KSP(CuS)
A. A B. B C. C D. D
难度: 中等查看答案及解析
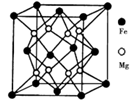
 的合成路线(部分反应条件略去)如图所示。
的合成路线(部分反应条件略去)如图所示。
 CH3COOCH2CH3。
CH3COOCH2CH3。