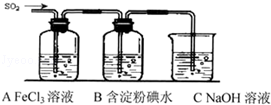
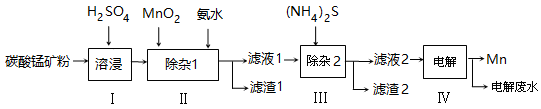
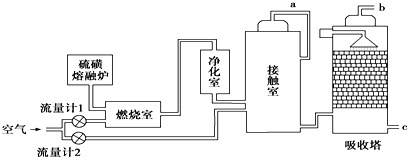
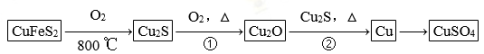
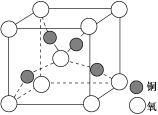
-
下列表述符合化学事实的是
A.某品牌化妆品声称“我们拒绝化学,本品不含任何化学物质”
B.用漂粉精和洁厕灵的混合液清洗马桶效果更佳
C.最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物
D.新核素的发现意味着新元素的合成
难度: 简单查看答案及解析
-
在蒸馏实验中,下列叙述不正确的是
A.在蒸馏烧瓶中放入几粒碎瓷片,防止液体暴沸
B.将温度计水银球放在蒸馏烧瓶支管口附近
C.冷水从冷凝管下口入,上口出
D.蒸馏烧瓶不用垫石棉网,可直接加热
难度: 简单查看答案及解析
-
在甲、乙两烧杯溶液中,分别含有大量的Cu2+、K+、H+、Cl﹣、CO32﹣、OH﹣6种离子中的3种,已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是
A.Cu2+、H+、Cl﹣ B.CO32﹣、OH﹣、Cl﹣
C.K+、H+、Cl﹣ D.K+、OH﹣、CO32﹣
难度: 中等查看答案及解析
-
Na2S2O3可作为脱氧剂,已知25.0mL0.100mol•L﹣1Na2S2O3溶液恰好与224mL(标准状况下)Cl2完全反应,则S2O32﹣
将转化成
A.S2﹣ B.S C.SO32﹣ D.SO42﹣
难度: 中等查看答案及解析
-
下列叙述正确的是
A.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
B.加水稀释溶液,溶液中的所有离子浓度都减小
C.金属铝的生产是以Al2O3为原料,在熔融状态下进行电解
D.NaHCO3溶液中含有少量Na2CO3可以用澄清石灰水除去
难度: 简单查看答案及解析
-
Na2O2、HCl、Al2O3 三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl﹣、OH﹣;且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为
A.3:2:1 B.2:4:1 C.
2:3:1 D.4:2:1
难度: 中等查看答案及解析
-
为了检验某固体物质中是否含有NH4+,你认为下列试纸和试剂一定用不到的是
①蒸馏水 ②NaOH溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀硫酸
A.①⑤ B.④⑤ C.①③ D.①④⑤
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对
位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性:Y>
X>W>Z
D.元素X、Z、W的最高化合价分别与其主族序数相等
难度: 中等查看答案及解析
-
已知H++OH﹣═ H2O生成1mol H2O放出57.3kJ热量,下列过程中放出热量为5
7.3kJ的是
A.1mol H2SO4与足量的NaOH溶液反应
B.稀盐酸与氨水反应生成1mol H2O
C.稀盐酸与Ba(OH)2溶液反应生成1mol H2O
D.稀NaOH与98%浓硫酸反应生成1mol H2O
难度: 中等查看答案及解析
-
分子式为C3H6ClBr的同分异构体共有(不考虑立体异构)
A.3种
B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
下列说法不正确的是
A.2014年西非国家爆发埃博拉病毒,双氧水、高锰酸钾溶液可以完全灭活该病毒感染性,其消毒原理和漂白粉消毒饮用水相同
B.2015年初公益调查《柴静雾霾调查:穹顶之下》发布,引起社会强烈反响。雾霾中PM2.5属于胶体
C.容量瓶、量筒和滴定管上都标有使用温
度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗
D.汽油、煤油、植物油都是油,但它们的主要成分不相同
难度: 中等查看答案及解析
-
某化学研究小组探究外界条件对化学反应
mA(g)+nB(g)
pC(g)的速率和平衡的影响图象如下,下列判断正确的是( )
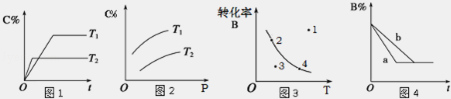
A.由图
1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n<p
C.图3中,表示反应速率v正>v逆的是点3
D.图4中,若m+n=p,则a曲线一定使用了催化剂
难度: 中等查看答案及解析
-
有关下图所示化合物的说法不正确的是
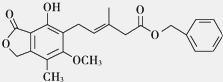
A.1mol该化合物最多可以与3molNaOH反应
B.既可以与Br2的CCl4溶液发生加成反应,又可在光照下与Br2发生取代反应
C.既可以催化加氢,又可以使酸性KMnO4溶液褪色
D.既可以与FeCl3溶液发生显色反应,又可与NaHCO3溶液反应放出CO2气体
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列说法正确的是
A.1mol•L ﹣1的NaClO溶液中含有ClO﹣的数目为NA
B.常温常压下,分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
C.标准状况下,11.2 L CH3CH2OH 中含有的氢原子数目为3NA
D.室温下,1L
pH=13的Ba(OH)2溶液中,OH﹣离子数目为0.2NA
难度: 中等查看答案及解析
-
能正确表示下列反应的离子反应方程式为
A.NH4HCO3稀溶液与过量的KOH稀溶液反应:NH4++HCO3﹣+2OH﹣=CO32﹣+NH3↑+2H2O
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42﹣沉淀完全:
2Al3++3SO42﹣+3Ba2++6OH ﹣=2Al(OH)3↓+3BaSO4↓
C.向FeBr2溶液中通入足量氯气:2Fe2++4Br﹣+3Cl2=2Fe3++2Br2+6Cl﹣
D.醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
难度: 中等查看答案及解析
-
现有6.4g铜与过量硝酸(8mol/L,50mL)充分反应,硝酸的还原产物为NO和NO2,反应后溶液中含有H+ 0.05mol。(
假定反应前后溶液体积不变),下列说法不正确的是
A.NO与NO2的物质的量之比为1:5
B.反应后溶液中所含NO3﹣的物质的量浓度为0.5 mol/L
C.被还原的硝酸的物质的量为0.15 mol
D.上述过程转移电子总的物质的量为0.2 mol
难度: 困难查看答案及解析
-
固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)
NH3(g)+HI(g);②2HI(g)
H2(g)+I2(g)达到平衡时,c(H2)=0.5mol•L﹣1,c(HI)=3mol•L﹣1,则此温度下反应①的平衡常数为
A.12 B.16 C.20 D.25
难度: 中等查看答案及解析
-
下列溶液的物质的量浓度关系正确的是( )
A.NaHCO3溶液中:c(Na+)>c(CO32﹣)>c(HCO3﹣)>c(OH﹣)
B.室温下,pH=3的盐酸与pH=11的氨水等体积混合,所得溶液中:c(Cl﹣)>c(NH4+)
C.0.1mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(CH3COO﹣)+c(OH﹣)=c(H+)+c(Na+)
D.CH3COONa溶液与CH3COOH溶液等物质的量混合后溶液呈酸性,所得溶液中:c(CH3COOH)>c(CH3COO﹣)>c(Na+)>c(H+)
难度: 困难查看答案及解析
-
25℃,向50mL 0.018mol/L AgNO3溶液中加入50mL 0.02mol/L 盐酸生成沉淀,已知:Ksp(AgCl)=1.8×10﹣10,则生成沉淀后的体系中c(Ag+)为( )
A.1.8×10﹣7mol/L B.1.8×10﹣8 mol/L C.1.8×10﹣9mol/L D.1.8×10﹣10mol/L
难度: 中等查看答案及解析
-
一种甲醇、氧气和强碱溶液做电解质的新型手机电池,可连续使用一个月,其电池反应为:2CH3OH+3O2+4OH﹣
2CO32﹣+6H2O,则有关说法正确的是 ( )
A.放电时CH3OH参与反应的电极为正极
B.放电时负极的电极反应为CH3OH+8OH﹣﹣6e﹣=CO32﹣+6H2O
C.标准状况下,通入5.6LO2并完全反应后,有0.5mol电子转移
D.放电一段时间后,通入氧气的电极附近溶液的pH降低
难度: 中等查看答案及解析