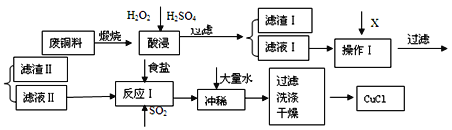
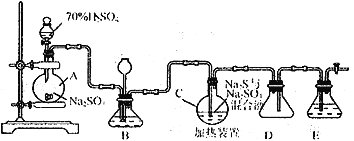
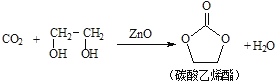
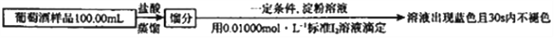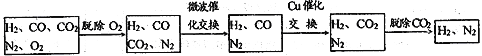-
化学与生产、生活密切相关,下列有关说法正确的是
A. 淀粉与纤维素互为同分异构体
B. 煤的气化、液化与石油的裂化、裂解均为化学变化
C. 被称为“黑金”的新型纳米材料石墨烯属于有机化合物
D. 糖类、油脂和蛋白质都属于营养物质,都能发生水解反应
难度: 简单查看答案及解析
-
下列关于维生素C(
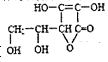 )的说法错误的是
)的说法错误的是A. 维生素C 可以发生加成反应
B. 维生素C 可以与金属Na发生置换反应
C. 维生素C具有还原性,只能发生氧化反应
D. 维生素C 可以与NaOH 溶液发生取代反应.
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A. 60gSiO2晶体中含有4NA条硅氧键
B. 1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
C. 25℃时,pH=13 的Ba(OH)2溶液中含有的OH-离子数为0.1 NA
D. K35ClO3 与浓H37Cl反应制得7.2 gCl2,则生成的Cl2分子数为0.1 NA
难度: 困难查看答案及解析
-
由铍和铝在元素周期表中的位置可知,二者的化合物具有相似的化学性质,已知反应:BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓ 能完全进行,则下列推断错误的是
A. BeO和Be(OH)2均既能溶于盐酸,又能溶于NaOH溶液
B. BeCl2是共价化合物,Na2BeO2是离子化合物
C. BeCl2水溶液呈酸性,将其蒸于并灼烧,残留物是BeCl2
D. Na2BeO2水溶液呈碱性,将其蒸干并灼烧,残留物为Na2BeO2
难度: 中等查看答案及解析
-
利用图示装置进行下列实验,能达到实验目的的是
溶液a
固体b
溶液c
实验目的:验证

A
浓硝酸
NaHCO3
Na2SiO3
非金属性:N>C>Si
B
浓盐酸
KMnO4
Na2S
氧化性:KMnO4>Cl2>S
C
浓盐酸
CaCO3
NaAlO2
酸性:HCl>H2CO3>Al(OH)3
D
浓氨水
CaO
酚酞溶液
NH3·H2O是弱碱
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,m、n、p、q依次为四种元素的单质;r、t、u 为二元化合物,其中u 是我国北方主要的大气污染物之一,可使品红溶液褪色;25℃,0.01mo/L的v溶液pH=12;上述物质间转化关系如图,下列说法错误的是

A. Y、Z、W的简单离子半径:W>Y>Z
B. W、Y 分别与X形成的简单化合物的沸点: Y>W
C. X和Y、Z和Y都能形成不止一种二元化合物
D. X、Y、Z、W 中任意三种元素形成的化合物都抑制水的电离
难度: 中等查看答案及解析