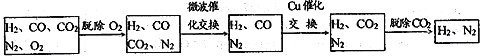-
高炉煤气是炼铁厂排放的尾气,含有H2、N2、CO、CO2及O2,其中N2约为55%、CO约为25%、CO2约为15%、O2约为1.64% (均为体积分数)。某科研小组对尾气的应用展开研究:
Ⅰ.直接作燃料
己知:C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol, 2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
(1)CO燃烧热的热化学方程式为__________________________________。
Ⅱ. 生产合成氨的原料
高炉煤气经过下列步骤可转化为合成氨的原料气:
在脱氧过程中仅吸收了O2;交换过程中发生的反应如下,这两个反应均为吸热反应:
CO2+CH4 CO+H2 CO+H2O
CO+H2 CO+H2O CO2+H2
CO2+H2
(2) 气体通过微波催化交换炉需要较高温度,试根据该反应特征,解释采用较高温度的原
因:________________________。
(3)通过铜催化交换炉后,所得气体中V(H2):V(N2)=______________________。
Ⅲ.合成氨后的气体应用研究
(4)氨气可用于生产硝酸,该过程中会产生大气污染物NOx。为了研究对NOx的治理,该研究小组在恒温条件下,向2L恒容密闭容器这加入0.2molNO和0.1molCl2,发生如下反应:2NO(g)+Cl2(g)  2ClNO(g) △H<0。10min 时反应达平衡,测得10min内v (ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=___________mol。
2ClNO(g) △H<0。10min 时反应达平衡,测得10min内v (ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=___________mol。
设此时NO的转化率为ɑ1,若其它条件不变,上述反应在恒压条件下进行,平衡时NO的转化率为ɑ2,则ɑ1_________ɑ2 (填“>”、“<”或“=”);平衡常数K_______(填“增大”“减小”或“不变”)
(5)氨气还可用于制备NCl3,NCl3发生水解产物之一具有强氧化性,该水解产物能将稀盐酸中的NaClO2氧化成ClO2,该反应的离子方程式为__________________________ 。
Ⅳ.一种用高岭土矿(主要成分为SiO2、Al2O3,含少量Fe2O3)为原料制备铝铵矾[NH4Al(SO4)2·12H2O]的工艺流程如图所示。回答下列问题:
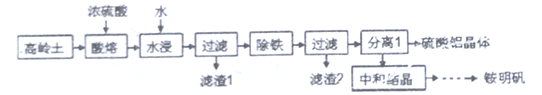
(6)当“酸溶”时间超过40min时,溶液中的Al2(SO4)3会与SiO2反应生成Al2O3·nSiO2,导致铝的溶出率降低,该反应的化学方程式为________________________。
(7)检验“除铁”过程中铁是否除尽的方法是_________________________。
(8)“中和”时,需控制条件为20℃和pH=2.8,其原因是__________________________。
-
高炉煤气是炼铁厂排放的尾气,含有H2、N2、CO、CO2及O2,其中N2约为55%、CO约为25%、CO2约为15%、O2约为1.64%(均为体积分数)。某科研小组对尾气的应用展开研究:
(1)直接作燃料
已知:C(s)+O2(g) CO2 (g) ΔH=-393.5kJ/mol
CO2 (g) ΔH=-393.5kJ/mol
2C(s)+O2(g) 2CO (g) ΔH=-221kJ/mol
2CO (g) ΔH=-221kJ/mol
CO燃烧热的热化学方程式为__________。
(2)生产合成氨的原料
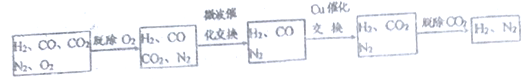
高炉煤气经过下列步骤可转化为合成氨的原料气:
在脱氧过程中仅吸收了O2,交换过程中发生的反应如下,这两个反应均为吸热反应:
CO2+CH4 CO+H2(未配平) CO+H2O
CO+H2(未配平) CO+H2O CO2+ H2
CO2+ H2
①气体通过微波催化交换炉需要较高温度,试根据该反应特征,解释采用较高温度的原因____________________________________________。
②通过铜催化交换炉后,所得气体中V(H2):V(N2)=__________。
(3)合成氨后的气体应用研究
①氨气可用于生产硝酸,该过程中会产生大气污染物NOx。为了研究对NOx的治理,该科研小组在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,发生如下反应:2NO(g)+Cl2(g) 2ClNO(g) ΔH<0。10min时反应达平衡,测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=__________mol。设此时NO的转化率为α1,若其它条件不变,上述反应在恒压条件下进行,平衡时NO的转化率为α2,则α1__________α2 (填“>”、“<”或“=”);平衡常数K__________(填增大”“减小 ”或“不变”)
2ClNO(g) ΔH<0。10min时反应达平衡,测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=__________mol。设此时NO的转化率为α1,若其它条件不变,上述反应在恒压条件下进行,平衡时NO的转化率为α2,则α1__________α2 (填“>”、“<”或“=”);平衡常数K__________(填增大”“减小 ”或“不变”)
②氨气还可用于制备NCl3,NCl3发生水解产物之一具有强氧化性,该水解产物能将稀盐酸中的NaClO2氧化成ClO2,该反应的离子方程式为__________。
-
高炉煤气是炼铁厂排放的尾气,含有H2、N2、CO、CO2及O2,其中N2约为55%、CO约为25%、CO2约为15%、O2约为1.64% (均为体积分数)。某科研小组对尾气的应用展开研究:
I.直接作燃料
己知:C(s)+O2(g)=CO2 (g) △H=-393.5kJ/mol
2C(s)+O2(g)=2CO (g) △H=-221kJ/mol
(1)CO燃烧热的热化学方程式为____________________________________________________________________________ 。
II.生产合成氨的原料
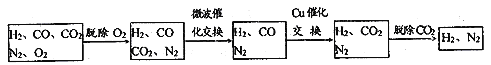
高炉煤气经过下列步骤可转化为合成氨的原料气:
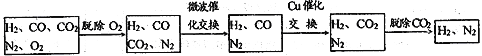
在脱氧过程中仅吸收了O2;交换过程中发生的反应如下,这两个反应均为吸热反应:CO2+CH4 CO+H2 CO+H2O
CO+H2 CO+H2O CO2+ H2
CO2+ H2
(2)气体通过微波催化交换炉需要较高温度,试根据该反应特征,解释采用较高温度的原因:____________________________________________________________________________ 。
(3)通过铜催化交换炉后,所得气体中V(H2):V(N2)= ______________。
III.合成氨后的气体应用研究
(4)氨气可用于生产硝酸,该过程中会产生大气污染物NOx。为了研究对NOx的治理,该科研小组在恒温条件下,向2L恒容密闭容器中加入0.2molNO 和0.1molCl2,发生如下反应:2NO(g)+Cl2(g) 2ClNO(g) △H<0。10min时反应达平衡,测得10min 内v (ClNO)=7.5
2ClNO(g) △H<0。10min时反应达平衡,测得10min 内v (ClNO)=7.5 10-3mol/(L·min),则平衡后n(Cl2)=_________mol。
10-3mol/(L·min),则平衡后n(Cl2)=_________mol。
设此时NO的转化率为α1,若其它条件不变,上述反应在恒压条件下进行,平衡时NO 的转化率为α2,则α1 ____α2 (填“>”、“<”或“=”);平衡常数K____ (填增大”“减小 ”或“不变”)
(5)氨气还可用于制备NCl3,NCl3发生水解产物之一具有强氧化性,该水解产物能将稀盐酸中的NaClO2氧化成ClO2,该反应的离子方程式为_____________________________。
-
高炉煤气是炼铁厂排放的尾气,含有H2、N2、CO、CO2及O2,其中N2约为55%、CO约为25%、CO2约为15%、O2约为1.64% (均为体积分数)。某科研小组对尾气的应用展开研究:
I.直接作燃料
己知:C(s)+O2(g)=CO2 (g) △H=-393.5kJ/mol
2C(s)+O2(g)=2CO (g) △H=-221kJ/mol
(1)CO燃烧热的热化学方程式为____________________________________________________________________________ 。
II.生产合成氨的原料
高炉煤气经过下列步骤可转化为合成氨的原料气:
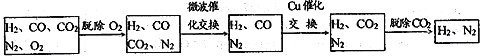
在脱氧过程中仅吸收了O2;交换过程中发生的反应如下,这两个反应均为吸热反应:CO2+CH4 CO+H2 CO+H2O
CO+H2 CO+H2O CO2+ H2
CO2+ H2
(2)气体通过微波催化交换炉需要较高温度,试根据该反应特征,解释采用较高温度的原因:____________________________________________________________________________ 。
(3)通过铜催化交换炉后,所得气体中V(H2):V(N2)= ______________。
III.合成氨后的气体应用研究
(4)氨气可用于生产硝酸,该过程中会产生大气污染物NOx。为了研究对NOx的治理,该科研小组在恒温条件下,向2L恒容密闭容器中加入0.2molNO 和0.1molCl2,发生如下反应:2NO(g)+Cl2(g) 2ClNO(g) △H<0。10min时反应达平衡,测得10min 内v (ClNO)=7.5
2ClNO(g) △H<0。10min时反应达平衡,测得10min 内v (ClNO)=7.5 10-3mol/(L·min),则平衡后n(Cl2)=_________mol。
10-3mol/(L·min),则平衡后n(Cl2)=_________mol。
设此时NO的转化率为α1,若其它条件不变,上述反应在恒压条件下进行,平衡时NO 的转化率为α2,则α1 ____α2 (填“>”、“<”或“=”);平衡常数K____ (填增大”“减小 ”或“不变”)
(5)氨气还可用于制备NCl3,NCl3发生水解产物之一具有强氧化性,该水解产物能将稀盐酸中的NaClO2氧化成ClO2,该反应的离子方程式为_____________________________。
-
高炉煤气为炼铁过程中产生的副产品,主要成分为N2、CO、CO2、H2O等,其中可燃成分CO含量约占25%左右,CO2、N2的含量分别占15%、55%。回答下列问题:
(1)上述提及的气体分子中,电子数相等的两种气体是________(写化学式)。
(2)高炉煤气中CO具有较高的利用价值,可以与H2合成甲烷,已知有关反应的热化学方程式如下:
① H2(g)+ O2(g)=H2O(l) △H=-285.8kJ/mol
O2(g)=H2O(l) △H=-285.8kJ/mol
② CO(g)+ O2(g)=CO2(g) △H=-283.0kJ/mol
O2(g)=CO2(g) △H=-283.0kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
则CO(g)+2H2(g)=CH4(g)+  O2(g) △H=_________kJ/mol。
O2(g) △H=_________kJ/mol。
(3)高炉煤气中N2的含量较高,利用CO前需要对CO 进行富集,实现CO和N2的分离。
① 工业上常采用醋酸亚铜氨溶液来吸收CO,该反应的热化学方程式为
CH3COOCu(NH3)2(aq)+CO(g)=CH3COOCu(NH3)2·CO(aq) △H<0。吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有______________(写出一种即可)。
②到目前为止,CO吸附剂的开发大多数以亚铜为活性组分负载在各种载体上,然后采用变压吸附(PSA)方式在含N2体系中脱出CO。下图是变压吸附回收高炉煤气中CO的流程图:

PSA-I吸附CO2时间对PSA-II中CO回收率的影响见下图,由此可见,为了保证载体亚铜吸附剂对CO的吸附和提纯要求,应采取的措施是________, “放空气体”的主要成分为_______。

(4)高炉炼铁过程中发生的主要反应为Fe2O3(s)+ 3 CO(g)===2Fe (s)+3CO2(g)。该反应在不同温度下的平衡常数如下表所示:
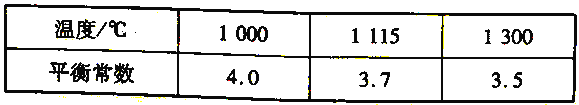
① 该反应的△H______0(填“> " " < ”或“= " )。
② 欲提高上述反应中CO 的转化率,可采取的措施是______。
a.适当降低反应体系的温度 b.及时移出体系中的CO2 c.加入合适的催化剂
d.减小容器的容积 e.增大Fe2O3的量
-
高炉煤气为炼铁过程中产生的副产品,主要成分为CO、CO2、N2等,其中CO含量约占25%左右。
(1)研究表明,由CO可以直接合成多种化工产品,如生产甲醇。
已知:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1453kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
CO(g)+2H2(g)=CH3OH(l) △H=-128.1kJ·mol-1。则CO(g)燃烧热为__________kJ·mol-1。
(2)人体中肌红蛋白(Mb)与血红蛋白(Hb)的主要功能为运输氧气与二氧化碳。肌红蛋白(Mb)可以与小分子X(如氧气或一氧化碳)结合,反应方程式为:Mb(aq)+X(g) MbX(aq)
MbX(aq)
①通常用p 表示分子X 的压力,p0 表示标准状态大气压,若X 分子的平衡浓度为p/p0,写出上述反应的平衡常数表达式:K=__________.请用p/p0 及K 表示吸附小分子的肌红蛋白(MbX)占总肌红蛋白的比例__________。
②在常温下,肌红蛋白与CO 结合反应的平衡常数K(CO)远大于与O2结合的平衡常数K(O2),下图最能代表结合率(f)与此两种气体压力(p)的关系的是____________
③人体中的血红蛋白(Hb)同样能吸附O2、CO2和H+,相关反应方程式及其化学平衡常数分别是:
Ⅰ.Hb(aq)+H+(aq) HbH+(aq);K1
HbH+(aq);K1
Ⅱ.HbH+(aq)+O2(g) HbHO2(aq)+H+;K2
HbHO2(aq)+H+;K2
Ⅲ.Hb(aq)+O2(g) HbO2(aq)K3
HbO2(aq)K3
Ⅳ.HbO2(aq)+H+(aq)+CO2(g) Hb(H+)CO2(aq)+O2(g);△H4
Hb(H+)CO2(aq)+O2(g);△H4
则K3=__________(用K1、K2表示),若低温下反应Ⅳ能自发进行,则该反应△H____0,△S__0(填“>”“<”或“=”)
(3)CO2的处理 方法有多种,将少量CO2气体通入石灰乳中充分反应,达到平衡后,测得溶液中c(OH-)=cmol/L,则c(CO32-)=_____mol/L(用含a、b、c的代数式表示)。(已知Kap(CaCO3)=a,Kap[Ca(OH)2]=b)
-
高炉炼铁是冶炼铁的主要方法。
(1)从炼铁高炉口排出的尾气中含有一定量的有毒气体________(填化学式),会污染空气。100多年前,人们曾耗巨资改建高炉,结果尾气中的该物质含量并未减少。高炉炼铁的主要反应方程式为(设铁矿石用磁铁矿)________。
(2)已知:①4Fe(s) + 3O2=2Fe2O3(s) ΔH1
②4Fe3O4(s)+O2(g)=6Fe2O3(s) ΔH2
③3Fe(s)+2O2(g)=Fe3O4(s) ΔH3
则ΔH2= (用含上述ΔH的代数式表示)。
(3)高铁酸钠(Na2FeO4)是铁的一种重要化合物,可用电解法制备,阳极材料为铁,其电解质溶液应选用_______ (填H2SO4、HNO3、KOH、NaOH、Na2SO4)溶液,原因是_____________,阳极反应式为_________________。
(4)某温度下,HX的电离平衡常数K为1×10-5。计算该温度下0.100mol/L的HX溶液的 H+浓度。(平衡时HX的浓度以0.100mol/L计,水的电离忽略不计,写出计算过程。)
-
下列说法正确的是
A. 增加炼铁高炉的高度可以减少尾气CO的排放
B. 在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同
C. 白炽灯工作时,电能全部转化为光能
D. 日本福岛核电站核泄漏事故提醒我们不要开发新能源,要大力挖掘化石能源
-
冶铁的原料有铁矿石、焦炭、空气和石灰石。测得某冶铁高炉煤气的体积分数为CO-0.28;CO2-0.10; N2-0.58,棕色烟尘-0.04(不含氮元素)。若每生产1000kg生铁排放煤气2400 m3,则至少需要补充空气(空气体积分数:N2-0.8 、O2-0.2;气体都在同温同压下测定)
A.1392 m3 B.1740 m3 C.1920 m3 D.2304 m3
-
冶铁的原料有铁矿石、焦炭、空气和石灰石。测得某冶铁高炉煤气的体积分数为CO-0.28;CO2-0.10; N2-0.58,棕色烟尘-0.04(不含氮元素)。若每生产1000kg生铁排放煤气2400 m3,则至少需要补充空气(空气体积分数:N2-0.8 、O2-0.2;气体都在同温同压下测定)
A.1392 m3 B.1740 m3 C.1920 m3 D.2304 m3
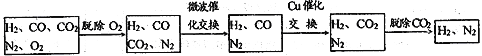
CO+H2 CO+H2O
CO2+ H2
2ClNO(g) △H<0。10min时反应达平衡,测得10min 内v (ClNO)=7.5
10-3mol/(L·min),则平衡后n(Cl2)=_________mol。

 CO+H2 CO+H2O
CO+H2 CO+H2O