-
下列说法中正确的是( )
A 同一原子中,2P、3P、4P能级的轨道数依次增多
B 3P4表示3P能级上有4个轨道
C 处于能量最低的原子叫做基态原子
D 同一原子中1S、2S、3S电子的能量逐渐减小
难度: 简单查看答案及解析
-
下列各原子的电子排布式正确的是( )
A Fe [Ar]3d54s3 B F- 1s22s22p5
C k [Ar] 3d1 D p 1s22s22p63s23p3
难度: 简单查看答案及解析
-
多电子原子中,下列能级次序排列正确的是( )
A.3s、3p、3d、4s B.4s、4p、3d、4d、
C.4s、3d、4p、5s D.1s、2s、3s、2p
难度: 简单查看答案及解析
-
基态碳原子的最外能层的各能级中,电子排布的方式正确的是 ( )
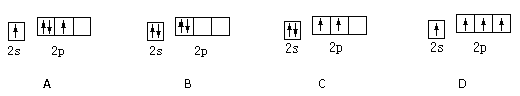
难度: 简单查看答案及解析
-
下列排列顺序中错误的为( )
A.原子半径 :O<S<Na B.稳定性 PH3<H2S<NH3
C. 电负性P<S<Cl D.第一电离能Na<Mg<Al
难度: 简单查看答案及解析
-
下列原子或离子原子核外电子排布不属于基态排布的是( )
A. N: 1s22s22p3 B. S2-: 1s22s22p63s23p6
C. Na: 1s22s22p53s2 D. Si: 1s22s22p63s23p2
难度: 简单查看答案及解析
-
下例说法中正确的是( )
A 在分子中,两个成键的原子间的距离叫做键长
B.含有极性键的分子一定是极性分子
C.键能越大,表示该分子越容易分解
D.H-Cl的键能为431.8KJ/mol-1,H-I的键能为298.7KJ/mol-1,这可以说明HCl分子比HI分子稳定
难度: 简单查看答案及解析
-
下列说法中不正确的是( )
A.气体单质中,一定有σ键,可能有π键
B.两个原子之间形成共价键时,最多有一个σ键
C.σ键比π键重叠程度大,形成的共价键强
D.N2分子中有一个σ键,两个π键
难度: 简单查看答案及解析
-
等物质的量的主族金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、VB、VC,已知VB=2VC,VA=VB+VC,则在C的生成物中,该金属元素的化合价为( )
A.+1 B.+2 C.+3 D.+4
难度: 简单查看答案及解析
-
下列各组元素属于P区的是( )
A.原子序数为1、2、7的元素 B.O、S、P
C.C.Fe、Ar、Cl D.Na、Mg、Al
难度: 简单查看答案及解析
-
下列事实与氢键有关的是( )
A.水加热到很高的温度都难以分解
B.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
C.NH3分子极易溶于水
D.HF、HCl、HBr、HI的热稳定性依次减弱
难度: 简单查看答案及解析
-
具有下列电子构型的原子中第一电离能最小的是( )
A.ns2np3 B.ns2np4 C.ns2np5 D.ns2np6
难度: 简单查看答案及解析
-
膦又称磷化氢,化学式为PH3,在常温下是一种无色有大蒜气味的有毒气体,它的分子呈三角锥形,以下关于PH3的叙述中正确的是 ( )
A.PH3是非极性分子 B.PH3是一种强氧化剂
C.PH3中有未成键电子对 D.PH3分子中P—H键是非极性键
难度: 简单查看答案及解析
-
下列分子或离子中,含有孤对电子的是
A.BF3 B.CH4 C.PCl3 D.NH4+
难度: 简单查看答案及解析
-
将14Si的电子排布式写成1S22S22P63S23PX 它违背了( )
A.能量守恒原理 B.泡利原理
C.能量最低原理 D.洪特规则
难度: 简单查看答案及解析
-
下列分子的中心原子杂化轨道的类型相同的是( )
A.BeCl2和BF3 B.H2O和NH3
C.CO2和SO2 D.HCHO和PCl3
难度: 简单查看答案及解析
-
主族元素X和Y ,Xm-和Yn+核外电子排布相同,下列说法正确的为( )
A.X的原子半径大于Y B.X和Y的核电荷数之差为m-n
C. 电负性X>Y D. 第一电离能X<Y
难度: 简单查看答案及解析
-
下列叙述中正确的是( )
A.BF3 、H2O和NH3 都是极性分子
B CO2和 C2H4都是含有极性键的非极性分子
C.HF、HCl、HBr、HI稳定性依次增强
D.NH3、SiH4、SO3都是四面体型分子
难度: 简单查看答案及解析
-
(8分)写出下列元素原子的电子排布式
P________,Cr________,
Al________, Cu________,
难度: 简单查看答案及解析