-
化学与社会、生活和生产息息相关,以下叙述不正确的是
A. 氢气的燃烧产物是水,是理想的清洁燃料,未来可以利用蓝绿藻和微生物制备氢气
B. 使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用
C. 生物炼铜的原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为硫酸铜
D. 硅晶体的导电性介于导体与绝缘体之间,是一种重要的半导体材料,广泛应用于制造集成电路、太阳能电池板等
难度: 中等查看答案及解析
-
科学家发现两种粒子:第一种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第二种是由四个氧原子构成的分子。下列有关这两种粒子的说法不正确的是
A. “零号元素”在元素周期表中与氢元素占同一位置
B. “四中子”的质量数为4,其质量比氢原子大
C. “四中子”不显电性
D. 第二种粒子的化学式为O4,与O2互为同素异形体
难度: 困难查看答案及解析
-
下列表示物质结构的化学用语正确的是
A. 二氧化碳的结构式: O=C=O B. HF的电子式:
C. Cl-离子的结构示意图:
 D. 中子数为20的氯原子:
D. 中子数为20的氯原子: 难度: 中等查看答案及解析
-
图甲和图乙表示的是短周期部分或全部元素的某种性质的递变规律,下列说法正确的是
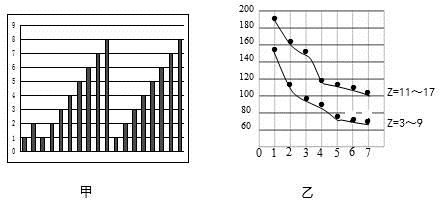
A. 图甲横坐标为原子序数,纵坐标表示元素的最高正价
B. 图甲横坐标为核电荷数,纵坐标表示元素的原子半径(单位:pm)
C. 图乙横坐标为最高正价,纵坐标表示元素的原子半径(单位:pm)
D. 图乙横坐标为最外层电子数,纵坐标表示元素的原子半径(单位:pm)
难度: 困难查看答案及解析
-
各图中表示热化学方程式A(g)+B(g)═C(g)+D(l)△H<0的是(E表示能量)( )
A.
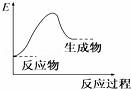 B.
B. 
C.
 D.
D. 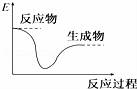
难度: 中等查看答案及解析
-
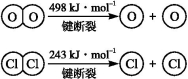
已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Cl2(g)=2HCl(g) ΔH=-Q1 kJ/mol
H2(g)+Br2(g)=2HBr(g) ΔH=-Q2 kJ/mol
有关上述反应的叙述正确的是
A.Q1<Q2
B.生成物总能量均高于反应物总能量
C.生成1molHCl气体时放出Q1热量
D.1molHBr(g)具有的能量大于1molHBr(l)具有的能量
难度: 中等查看答案及解析
-
如图是课外活动小组设计的用化学电源使LED灯发光装置。下列说法不正确的是
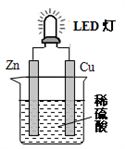
A. 锌是负极,电子从锌片经导线流向铜片
B. 氢离子在铜片表面被还原
C. 装置中存在“化学能→ 电能→ 光能”的转换
D. 如果将硫酸换成橙汁,导线中不会有电子流动
难度: 中等查看答案及解析
-
下列变化需克服共价键的是
A. 干冰受热变成二氧化碳气体 B. 金刚石熔化 C. 蔗糖溶于水 D. 食盐溶于水
难度: 中等查看答案及解析
-
下列各组顺序的排列不正确的是
A. 熔点:金刚石>干冰 B. 离子半径:O2-> Na+
C. 碱性:KOH > Al(OH)3 D. 稳定性:SiH4> H2S
难度: 中等查看答案及解析
-
已知钍
的原子可发生下列放射性变化:
→
+
,生成的X是与Mg同主族的一种元素的原子,下列对X的推断不正确的是
A. X元素位于第六周期 B. X的氢氧化物是一种强碱
C. X的碳酸盐难溶于水 D. X的最高化合价为+2价
难度: 困难查看答案及解析
-
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是
选项
规律
结论
A
同主族元素性质的相似性
钠和氧反应可以形成Na2O2,也可以和硫形成Na2S2
B
反应物浓度越大,反应速率越快
常温下,相同的铁片分别加入足量的稀硫酸和浓硫酸中,浓硫酸中铁片先溶解完
C
结构和组成相似的物质,沸点随相对分子质量增大而升高
H2O沸点低于H2S
D
较强酸可以制取较弱酸
亚硫酸和次氯酸钙反应可以制取次氯酸
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
已知4NH3(g)+5O2(g)
4NO(g)+6H2O(g)△H<0,下列有关叙述正确的
A.上述反应的化学反应速率关系:2 v(NH3)=3 v(H2O)
B.若在2L的密闭容器中反应,经3min后NH3的物质的量由10mol变为7mol则v (NH3)=0.5mol·L-1·s-1
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.若降低温度,反应速率将会减小
难度: 中等查看答案及解析
-
在一定条件下的定容密闭容器中反应:A(s) + 2B(g)
C(g) + D(g),当下列物理量不再变化时,不能表明该反应已达平衡的是
A. 混合气体的压强 B. 混合气体的密度
C. B的物质的量浓度 D. 混合气体的平均相对分子质量
难度: 困难查看答案及解析
-
按下图的装置进行实验,若图中x轴表示阴极的电子的量,则y轴可能表示
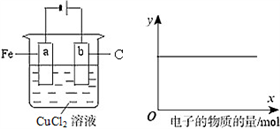
A. Cu2+物质的量浓度 B. Fe棒的质量 C. C棒的质量 D. Cl-物质的量浓度
难度: 中等查看答案及解析
-
下表为元素周期表的一部分,X、Y、Z、R为短周期元素,其中Y元素的原子最外层电子数是其内层电子数的3倍。下列说法正确的是
A. 原子半径大小关系为: R> Y > X
B. X有多种同素异形体,而Y不存在同素异形体
C. 根据元素周期律,可以推测W元素的单质具有半导体特性,W2Y3具有氧化性和还原性
D. ZY2晶体熔化、液态RY3气化均需克服分子间作用力
难度: 中等查看答案及解析
-
两种短周期元素X和Y形成的单质能与氢气反应生成HX和HY,反应热分别为ΔH1和ΔH 2,已知ΔH1>ΔH 2,则判断一定正确的是
A. 沸点:HY>HX B. 还原性:HY>HX
C. 酸性:HXO4>HYO4 D. 稳定性:HY>HX
难度: 困难查看答案及解析
-
在一定温度下,将2 mol SO2和1 mol O2充入一定容积的密闭容器中,在催化剂作用下发生如下反应:2SO2(g)+O2(g)
2SO3(g);ΔH=-197 kJ·mol-1,当达到化学平衡时,下列说法中正确的是
A. 生成SO3 2 mol B. 放出197 kJ热量 C. SO2和SO3共2 mol D. 含氧原子共8 mol
难度: 困难查看答案及解析

 2Cl2+2H2O
2Cl2+2H2O