-
航天飞机用高氯酸铵(NH4ClO4)与铝粉的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,方程式为:2NH4ClO4(s)
N2(g)+4H2O(g)+Cl2(g)+2O2(g) △H = -Q kJ/mol下列不正确的是
A.上述反应属于分解反应
B.上述反应瞬间产生大量高温气体推动航天飞机飞行
C.反应从能量变化上看,主要是化学能转变为热能和动能
D.在反应中高氯酸铵只起氧化剂的作用
难度: 简单查看答案及解析
-
下列反应中生成物总能量高于反应物总能量的是
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
难度: 简单查看答案及解析
-
反应:H2S(g)+aO2(g)═X+cH2O(l),△H,若△H表示H2S燃烧热,则X为
A.S(s) B.SO2(g) C.SO3(g) D.SO3(l)
难度: 简单查看答案及解析
-
下列情况下的反应一定能自发进行的是
A.△H>0 △S<0 B.△H>0 △S>0
C.△H<0 △S<0 D.△H<0 △S>0
难度: 简单查看答案及解析
-
要增大铁与盐酸反应的速率,所采取的下列措施中无效的是
A.增大盐酸的浓度 B.提高反应的温度
C.增大压强 D.用铁粉代替铁片
难度: 简单查看答案及解析
-
对于化学反应3W(g)+2X(g)===4Y(g)+3Z(g),下列反应速率关系中,正确的是
A.v (W)=3v(Z) B.2v(X)=3v(Z)
C.2v(X)=v(Y) D.3v(W)=2v(X)
难度: 简单查看答案及解析
-
一定条件下体积不变的密闭容器中,反应2A(g)+2B(g)
3C(g)+D(g)达到平衡状态的标志是
A.单位时间内生成2n mol A,同时生成n mol D
B.容器内压强不随时间而变化
C.单位时间内生成n mol B,同时消耗1.5n mol C
D.容器内混合气体密度不随时间而变化
难度: 简单查看答案及解析
-
对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
A.加入一种反应物 B.升高温度
C.对平衡体系增加压强 D.使用催化剂
难度: 简单查看答案及解析
-
合成氨所需的氢气可由水煤气反应制得,其中的一步反应为:CO(g) +H2O(g) ⇌CO2(g) +H2(g);△H=﹣43kJ/mol对于上述反应,下列措施中能提高CO转化率的是
A.增大压强 B.升高温度
C.增大水蒸气的浓度 D.增大CO的浓度
难度: 简单查看答案及解析
-
下列有关热化学方程式的叙述正确的是
A.已知2H2 (g)+O2(g)═2H2O(g)△H=﹣483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
B.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.4kJ/mol
C.已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定
D.已知C(s)+O2(g)═CO2(g) △H1;C(s)+1/2 O2(g)═CO(g)△H2,则△H1>△H2
难度: 中等查看答案及解析
-
在2A+B⇌3C+4D反应中,表示该反应速率最快的是
A.v(A)=0.5 mol﹒L-1﹒s-1
B.v(B )=0.3 mol﹒L-1﹒s-1
C.v(C)=0.8 mol﹒L-1﹒s-1
D.v(D)=1.6 mol﹒L-1﹒min-1
难度: 简单查看答案及解析
-
在温度和容积不变的容器中,一定条件下发生下列变化:H2(g)
2H(g)(气态氢原子)。△H>0。当容器中H2的浓度从0.1mol/L变为0.06mol/L时,需20秒,那么H2的浓度由0.06mol/L下降到0.036mol/l时需时间
A.12秒 B.无法判断 C.大于12秒 D.小于12秒
难度: 中等查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH- (aq)=H2O(l);△H= -57.3kJ/mol。向lL 0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时,反应热△H1、△H2、△H3的关系正确的是
A.△ H1>△ H2>△ H3 B.△ H2>△ H3>△ H1
C.△ H1>△ H3>△ H2 D.△ H3>△ H2>△ H1
难度: 中等查看答案及解析
-
在体积固定的密闭容器中加入2 mol A和1 mol B,发生反应:2A(g)+B(g)⇌3C(g)+D(g),达到平衡时C的浓度为a mol/L.若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为a mol/L的是
A.4mol A+2mol B
B.2mol A+1mol B+3mol C+1mol D
C.3mol C+1mol D+1mol B
D.3mol C+1mol D
难度: 困难查看答案及解析
-
在一定温度下将lmol CO(g)和lmol H2O(g)通入一个容积固定的密闭容器中反应:CO(g) +H2O(g)
CO2(g)+H2(g),达到平衡后CO2的物质的量为0.6mol,再通入4molH2O(g),当再次达到平衡后,CO2的物质的量可能是
A.n(CO2)=0.6 mol
B.n(CO2)=1 mol
C.1 mol<n(CO2)<4 mol
D.0.6 mol<n(CO2)<1 mol
难度: 中等查看答案及解析
-
已知反应:2NO2 (g)⇌N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用止水夹夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是

A.上述过程中,A烧瓶内正、逆反应速率均加快
B.上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大
C.上述过程中,A、B烧瓶内气体密度均保持不变
D.反应2NO2(g)⇌N2O4(g)的逆反应为放热反应
难度: 中等查看答案及解析
-
密闭容器中反应:aX(g)+bY(g)⇌cZ(g)+dW(g),反应达平衡后,保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为原平衡的1.8倍.下列不正确的是
A.a+b>c+d B.平衡向逆反应方向移动
C.Z的体积分数减小 D.X的转化率下降
难度: 中等查看答案及解析
-
某温度时,向三个体积相等的恒容密闭容器A、B、C中,分别加入① 2 mol HI;②3mol HI;③ 1mol H2与1mo1 I2;发生反应2HI (g)
H2(g)+I2(g),分别达平衡时,以下关系正确的是
A.平衡时,各容器的压强:②=①=③
B.平衡时,I2的浓度:②>①=③
C.平衡时,I2的体积分数:②>①=③
D.从反应开始到达平衡的时间:②>①
难度: 困难查看答案及解析
-
在密闭容器中进行反应:A(g)+3B(g)
2C(g),有关下列图象说法的不正确的是
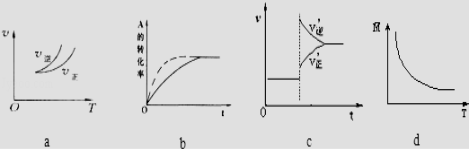
A.依据图a可判断正反应为放热反应
B.在图b中,虚线可表示使用了催化剂
C.若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动
D.由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的△H>0
难度: 中等查看答案及解析
-
一定条件下,向密闭恒容容器中加入1.0mol/L X,发生反应:2X(g)⇌Y(g)+Z(g),△H<0,反应到8min时达到平衡;在14min时改变的温度,16min时建立新平衡.X的物质的量浓度变化如图所示.下列有关说法正确的是

A.0~8min用Y表示的该反应的速度为0.1mol/(L﹒min)
B.8min时达到平衡,该反应的平衡常数为 K=0.5
C.14min时,改变的反应条件是降低了体系的温度
D.16min时的正反应速率,比8min时的正反应速率大
难度: 困难查看答案及解析
-
(10分)常温常压下,断裂1mol气体分子化学键所吸收的能量或形成1mol气体分子化学键所放出的能量称为键能(单位为kJ.mol-1),根据下表键能数据(kJ·mol-1)回答问题:
化学键
C-F
C-Cl
C-I
H-H
S=S
H-S
键能
427
330
218
436
255
339
(1)由表中数据预测C-Br键的键能范围:_________<C-Br键能<_________(回答数值和单位)
(2)热化学方程式2H2(g)+S2(g) = 2H2S(g);△H= QkJ·mol-1;则Q=
(3)已知下列热化学方程式:
①O2 (g) = O+2(g) + e-
H1= +1175.7 kJ·mol-1 ②PtF6(g) + e- = PtF6—(g)
H2= -771.1 kJ·mol-1
③O2+PtF6-(s) = O2+(g) + PtF6-(g)
H3= +482.2 kJ·mol-1
则反应O2(g) + (g) = O2+PtF6-(s)
H=_____________ kJ·mol-1。
难度: 困难查看答案及解析
