-
检测明矾样晶(含砷酸盐)中的砷含量是否超标,实验装置如下图所示(夹持装置已略去)。

【实验1】配制砷标准溶液
①取0.132gAg2O3,用NaOH溶液完全溶解后,配制成1LNa3AsO3溶液(此溶液1mL相当于0.10mg砷);
②取一定量上述溶液,配制1L含砷量为1mg·L-1的砷标准溶液。
(1)步骤①中,必须使用的玻璃仪器除烧杯、玻璃棒外,还有__________。步骤②需取用步骤①中Na3AsO3溶液____mL。
【实验2】制备砷标准对照液
①往A瓶中加入2.00mL砷标准溶液,再依次加入一定量的盐酸、KI溶液和SnCl2溶液,混匀,室温放置10 min,使砷元素全部转化为H3AsO3。
②往A瓶中加入足量锌粒(含有ZnS杂质),立即塞上装有乙酸铅棉花的导气管B,并使B管右侧末端插入比色管C中银盐吸收液的液面下,控制反应温度25~40℃,45 min后,生成的砷化氢气体被完全吸收,Ag+被还原为红色胶态银。
③取出C管,向其中添加氯仿至刻度线,混匀,得到砷标准对照液。
(2)乙酸铅棉花的作用是_____________________。
(3)完成生成砷化氢反应的离子方程式:
____Zn+____H3AsO3+____H+=____( )+ ____Zn2++____( )________________
(4)控制A 瓶中反应温度的方法是________________________;反应中,A瓶有较多氢气产生,氢气除了搅拌作用外,还具有的作用是_____________________________。
(5)B管右侧末端导管口径不能过大(约为1mm),原因是__________________________。
【实验3】判断样品中砷含量是否超标
称取ag明矾样品替代【实验2】 ①中“2.00m砷标准溶液”,重复【实验2】后续操作。将实验所得液体与砷标准对照液比对,若所得液体的颜色浅,说明该样品含砷量未超标,反之则超标。
(6)国标规定砷限量为百万分之二(质量分数),则a的值为______________________。
-
聚合硫酸铁(PFS) 是一种高效的无机高分子絮凝剂。某工厂利用经浮选的硫铁矿烧渣 (有效成分为Fe2O3和Fe3O4) 制备PFS,其工艺流程如下图所示。
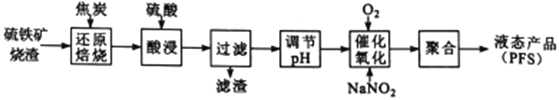
(1)“还原焙烧”过程中,CO还原Fe3O4生成FeO的热化学方程式为___________________________。
已知:Fe3O4(s)+C(s)=3FeO(s)+CO(g) ΔH1= 191.9kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ·mol-1
C(s)+CO2(g) =2CO(g) ΔH3= 172.5kJ·mol-1
(2)CO是“还原焙烧" 过程的主要还原剂。下图中,曲线表示4个化学反应a、b、c、d达到平衡时气相组成和温度的关系,Ⅰ、Ⅱ、Ⅲ、Ⅳ分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域。a属于_________(填“吸热反应”或“放热反应”);570℃时,d反应的平衡常数K=_________________。

(3)工业上,“还原培烧”的温度一般控制在800℃左右,温度不宜过高的理由是____________________。
(4)若“酸浸”时间过长,浸出液中Fe2+含量反而降低,主要原因是___________________________。
(5)已知:25℃时,Ksp[Fe(OH)2]=1.0×10-17, Ksp[Fe(OH)3]=1.0×10-39,若浸出液中c(Fe2+) =10-1.8mol·L-1,为避免“催化氧化”过程中产生Fe(OH)3,应调节浸出液的pH≤_____________。
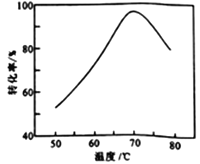
(6)FeSO4溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4,该反应的离子方程式为_________________________。“催化氧化”过程用NaNO2作催化剂(NO起实质上的催化作用)时,温度与Fe2+转化率的关系如右图所示(反应时间相同),Fe2+转化率随温度的升高先上升后下降的原因是_______________________________。
-
过二硫酸钾(K2S2O8) 在科研与工业上有重要用途。
(1)S2O82-的结构式为 ,其中S元素的化合价为_________________。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是___________(填离子符号)。
,其中S元素的化合价为_________________。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是___________(填离子符号)。
(2)某厂采用湿法K2S2O8氧化脱硝和氨法脱硫工艺综合处理锅炉烟气,提高了烟气处理效率,处理液还可以用作城市植被绿化的肥料。
①脱硫过程中,当氨吸收液的pH=6时,n(SO32-)∶n(HSO3-) =________。
[巳知:25℃时,Ka1(H2SO3)=1.5×10-2,K a2(H2SO3)=1.0×10-7]
②脱硝过程中依次发生两步反应:第1步,K2S2O8将NO氧化成HNO2,第2步,K2S2O8继续氧化HNO2,第2步反应的化学方程式为______________________________________;
一定条件下,NO去除率随温度变化的关系如右图所示。80℃时,若NO初始浓度为450mg·m-3,t min达到最大去除率,NO去除的平均反应速率:
v(NO) =____mol·L-1·min-1(列代数式)
(3)过二硫酸钾可通过“电解→转化→提纯”方法制得,电解装置示意图如右图所示。

①电解时,铁电极连接电源的_________________极。
②常温下,电解液中含硫微粒的主要存在形式与pH的关系如下图所示。
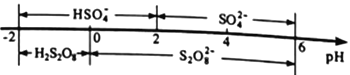
在阳极放电的离子主要是HSO4-,阳极区电解质溶液的pH范围为_________,阳极的电极反应式为________________________。
③往电解产品中加入硫酸钾,使其转化为过二硫酸钾粗产品,提纯粗产品的方法_______________。
-
钛及其化合物的应用正越来越受到人们的关注。
(1)基态下原子核外电子排布的最高能级的符号是_____________。与钛同周期的元素中,基态原子的未成对电子数与钛相同的有_____种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是________________________。
(3)TiCl4是氯化法制取钛的中间产物。TiCl4和SiCl4在常温下都是液体,分子结构相同。采用蒸馏的方法分离SiCl4和TiCl4的混合物,先获得的馏分是______________(填化学式)。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如右图所示。

①组成该物质的元素中,电负性最大的是____________ (填元素名称)。
②M中,碳原子的杂化形式有________种。
③M中,不含_________(填标号)。
a. π键 b. σ键 c.配位键 d.氢键 e.离子键
(5)金红石(TiO2)是含钛的主要矿物之一,具有四方晶系结构。其晶胞结构(晶胞中相同位置的原子相同)如下图所示。
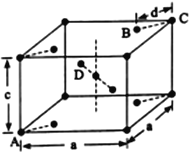
①4个微粒A、B、C、D中,属于氧原子的是______________。
②若A、B、C的原子坐标分别为A (0,0,0)、B (0.69a,0.69a,c)、c (a, a,c),则D的原子坐标为D (0.19a,_____,______);钛氧键的键长d=________________(用代数式表示)。
-
喹啉醛H 是一种可用于制备治疗肿瘤药物的中间体。由烃A制备H的合成路线如下:
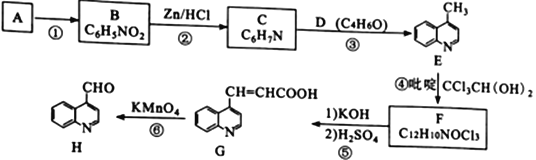
巳知:i.RCCl3 RCOOK;ii.反应④中,吡啶作稳定剂
RCOOK;ii.反应④中,吡啶作稳定剂
回答下列问题:
(1)A的化学名称是__________________________。
(2)①、⑥的反应类型分别为_______________、________________。
(3)D为链状结构,分子中不含“—O—”结构,且不能发生银镜反应,其核磁共振氢谱为3组峰,峰面积比为3:2:1,D的结构简式为________________________。
(4)反应④的化学方程式为______________________________________。
(5)下列有关G的说法正确的是________________ (填标号)。
a.经质谱仪测定,G只含有羧基、碳碳双健两种官能团
b.属于萘的衍生物
c.一定条件下可发生加聚反应
d.可与少量Na2CO3溶液反应生成NaHCO3
(6)X是H的同分异构体,两者环状结构相同,X环上的取代基与H的相同但位置不同,则X可能的结构有____种。
(7)写出用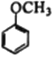 为原料制备
为原料制备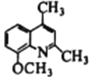 的合成路线________________(其他试剂任选)。
的合成路线________________(其他试剂任选)。
 ),拓展了人工合成自然产物的技术。下列有关该烃的说法正确的是
),拓展了人工合成自然产物的技术。下列有关该烃的说法正确的是





 ,其中S元素的化合价为_________________。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是___________(填离子符号)。
,其中S元素的化合价为_________________。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是___________(填离子符号)。




 为原料制备
为原料制备 的合成路线________________(其他试剂任选)。
的合成路线________________(其他试剂任选)。